科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇(CH3OH )燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:(11分)
)燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:(11分)
(1)这种电极放电时发生的总反应是______________________________________。
(2)此电极的正极发生的电极反应式是__________________________;
负极发生的电极反应式是_______________________________。
(3)电解液中的 离子向_________极(正极或负极)移动;通入正极的气体是________.
离子向_________极(正极或负极)移动;通入正极的气体是________.
有原子序数依次增大的五种主族元素X、Y、Z、W、R,已知:①X与Z,Y、R与W分别同族;②X、Z、W分别与Y都可组成两种中学常见的化合物;③Y的阴离子与Z的阳离子的核外电子排布相同。根据以上叙述回答问题:
(1)R单质可用作半导体材料,写出该元素名称它与Y元素原子序数差为_____
(2)用电子式表示化合物X2W的形成过程__________________________________。
(3)写出2种均由X、Y、Z、W 4种元素所组成的化合物在水溶液中发生反应的化学方程式_________________。Z、X、W三种元素组成的盐溶于水呈碱性,溶液中离子浓度大小顺序为:______________________________。
(4)X、Y两元素的单质已被应用于宇宙飞船的燃料电池,其结构如图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。b电极上的电极反应式为_______。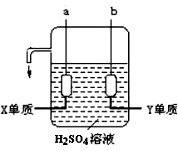
(5)请写出Z元素单质的一种用途_______。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)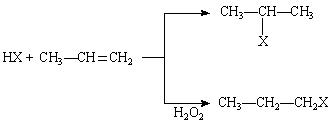 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。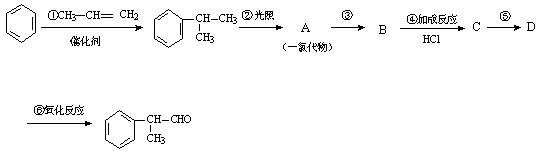
请根据上述路线,回答下列问题:
(1)A的结构简式可能为________________、____________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。[
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)工业生产中,中间产物A必须经反应③④⑤制得D,而不采取直接将A转化为D,其原因是___________________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有(选填序号)。
①加成反应②酯化反应③加聚反应④氧化反应
(2)B分子所含官能团的名称是、
(3)B分子中没有支链,其结构简式是 与B具有相同官能团的同分异构体的结构简式是。
与B具有相同官能团的同分异构体的结构简式是。
(4)由B制取A的化学方程式是。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取: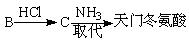
天门冬氨酸的结构简式是。
(1)乙醇的分子结构如右图:
其中①②③④⑤表示化学键的代号,用代号回答:
i乙醇与钠反应断裂的键是_;
ii乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是。
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,看到铜丝表面变成色,这是因为生成了。趁热将它反复插入盛乙醇的试管中,铜丝表面又变成色,并有气味的物质生成,总反应的化学方程式。
[化学——有机化学基础]
现有一种有机物A,分子式为C4H6O6。对于A的结构与性质实验结论如下:
i:A的分子中有两个羧基;
ii:A的核磁共振氢谱如右图所示;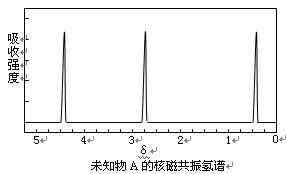
下图是利用烃B和烃I合成有机物A和一种高分子新材料R的转化关系示意图,已知烃I的相对分子质量为28,且F的相对分子质量比E多28。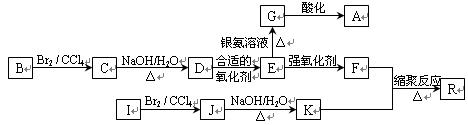
已知:①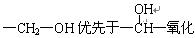
②同一个碳原子上连有多个羟基的结构极不稳定,不予考虑。
请分析并按要求回答下列问题:
(1)写出A对应的结构简式:;
(2)写出对应反应的化学方程式:
C→D:;反应类型为:______________________;
E→G:;
F+K→R:;
(3)有机物E的同分异构体M满足下列三个条件:
①1 mol有机物与银氨溶液充分反应生成2 mol Ag
②1 mol有机物与足量NaHCO3溶液反应产生1 mol CO2
③1 mol有机物与足量金属Na反应产生1 mol H2
请判断M的结构可能有种,任写一种M的结构简式。