已知:一个碳原子上连有两个羟基时,易发生下列转化:
请根据下图作答: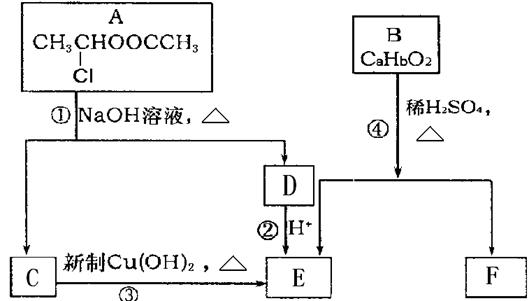
(1)A的核磁共振氢谱中出现 组峰;E中含有的官能团的名称是 。
组峰;E中含有的官能团的名称是 。
(2)反应③的化学方程式为 。
(3)已知B的相对分子质量为162,其完全燃烧的产物中CO 2和H2O的物质的量之比为 n(CO2)︰n(H2O)=2︰1,则B的分子式为 。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:
①属于芳香族化合物; ②能跟FeCl3溶液发生显色反应;
③能发生加聚反应; ④苯环上的一氯代物只有两种。
F在一定条件下发生加聚反应的化学方程式为 。
(5)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有 种结构,写出其中不含甲基的同分异构体的结构简式 。
(I)已知:在298 K、1.01KPa下,由稳定的单质发生反应生成1 mol气态化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
请你归纳出
(I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________;
写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H =______ KJ/mol。
(II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热△H ="=" KJ/mol。
(III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应:
负极:正极:
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是___________,俗称___________,其水溶液显___________性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________________。
等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者___________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为______________________。
除去下列物质中的杂质(括号内为杂质),试选用合适的试剂进行填空。(填写字母序号)
选择的试剂:
| A.盐酸 | B.水 | C.饱和食盐水 | D.AgNO3溶液 E.NaOH溶液 |
F.氯水 G.硫酸铜溶液 H.硫酸溶液 I.铁 J .CO2
(1)FeCl3(FeCl2)________,(2)NaHCO3溶液(Na2CO3):,
(3)NaNO3溶液(NaBr),(4) SiO2(CaCO3固体),
(5)Mg(Al)
若检验某溶液中是否存在下列离子:SO32-、SO42-、CO32-、S2-、Cl-、Br-、I-,根据下列事实分别做出适当结论:
(1)若溶液呈强酸性,不能大量存在的离子是 。
(2)先加盐酸酸化,再加BaCl2溶液,无沉淀产生,则不存在的离子是 。
(3)加入氯水后溶液仍为无色透明,不存在的离子是 。
在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。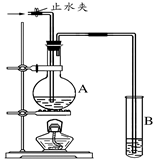
请回答下列问题:
(1) 若向A中通入足量的二氧化硫气体,A中的现象是。
(2) 若向A中通入足量的氯气后,再加热A,A中的溶液
(填“能”或“不能”)恢复到原来的颜色。