利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题: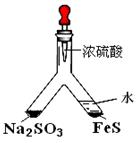
(1)实验目的:验证SO2有氧化性。
将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,在支管交叉处实验现象为__________________________________;
硫化亚铁处加水的目的是____________________________。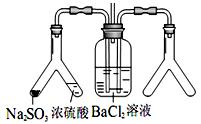
(2)实 验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。
验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。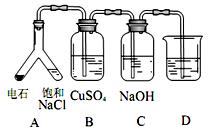
(3)实验目的:探究电石气中的成分。
①装置 A中发生的主要化学反应方程式为:___________________________。
② B装置中出现黑色沉淀,C 装置的作用为__________。
③为验 证电石气的主要成分,D中盛放______________。
证电石气的主要成分,D中盛放______________。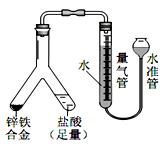
(4)实验目的:锌铁合金中铁含量的测定
①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是___________________。
②若称得锌铁合金的质量为 0.117g,量气管中初读数为 1. 00mL,末读数为 45.80mL,则合金中铁的含量为_____%(保留2 位小数,已折算标况)。
某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体。
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性。
请写出Ca在空气中燃烧发生反应的化学方程式:。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:。
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2)。臭氧还原为氧气。反应式为:O3+2KI+H2O=O2+I2+2KOH 【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有;
假设3:该臭味气体含有。
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验。请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选)。
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水。设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论。
| 实验操作 |
预期现象和结论 |
| 取少量反应后固体于试管中, 。 |
熟悉实验仪器,能正确进行实验操作是做好化学实验的前提。
(1)下列有关实验操作或实验事实的叙述,正确的是(填序号)。
A.实验室中浓硝酸应保存在棕色细口瓶中,并贴有如图所示标签 |
| B.用50mL量筒量取5.6mL浓硫酸 |
| C.中和滴定实验时,锥形瓶洗涤干净并用标准液润洗后,方可注入待测液 |
| D.用四氯化碳萃取碘水中的碘,分液时有机层从分液漏斗的下端放出 |
E.用广泛pH试纸测得某溶液的pH为4.8
(2)下图是实验室制备氯气并探究氯气是否具有漂白性的实验装置(夹持及加热仪器已省略)。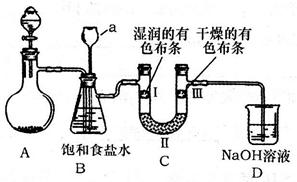
①A装置中反应的化学方程式为。
②B装置中仪器a的名称是。
③B装置的作用是除去气体中混有的HCl,兼起安全瓶的作用,当仪器a中液面不
断上升时,说明,此时应停止实验。
④实验中观察到,说明干燥氯气无漂白性。
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验I:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6mol/LHCl或6mol/LH2SO4,其它试剂任选。)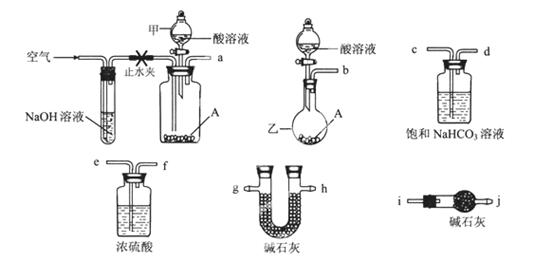
回答下列问题:
(1)仪器乙的名称为________。
(2)请选择必要的装置完成实验II,正确的连接顺序为________ (按气流方向,用接口字母表示);选用的酸溶液是________。
(3)有人提出不采用实验I,可在实验II结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2〜3次,将洗涤液过滤,洗涤沉淀2〜3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是_________________,实际上未采用该方案的原因是不符合实验设计的________原则(填字母编号)。
| A.科学性 | B.安全性 | C.可行性 | D.简约性 |
(4)x与y的关系式是________ (用等式表示)。
(5)通过实验I的相关数据,经计算可得A的摩尔质量为602.0g. mol-1。实验II中称得样品A的质量为9.030g,与足量酸完全反应后,CO2吸收装置增重0.660g,则A 的化学式为________。
某探究小组采用下图所示装置进行Fe粉与水蒸气的反应。
(1)实验前检查装置气密性的方法为________________________________________________________。
(2)检验实验中生成气体的实验操作是_____________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,无气泡 |
| 2 |
取步骤1中溶液,滴加酸性KMnO4溶液 |
紫色褪去 |
紫色褪去 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是。
②甲组步骤1中反应的离子方程式为。
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因是;验证方法为。
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图: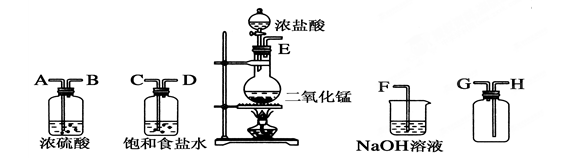
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)写出下列化学反应的方程式。
①气体发生装置中进行的反应:________________________________________。
②NaOH溶液中发生的反应:__________________________________________ 。