(1)室温时氢氧化钙的溶度积Ksp=4.7×10-6,室温时将9mL 0.02mol·L-1的氯化钙溶液与1mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中
沉淀析出(填有或无)。
(2)2 .24升(标准状态)氨气通入250mL浓度为0.1mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度由大到小的顺序为 。
.24升(标准状态)氨气通入250mL浓度为0.1mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度由大到小的顺序为 。
(3)用下图完成相应实验。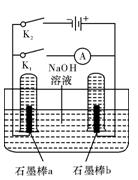
①断开K1,闭合K2接通直流电源,写出阳极的电极反应式 ;
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电 路中有电流通过。写出a极的电极反应式 。
路中有电流通过。写出a极的电极反应式 。
【化学——选修3:物质结构与性质】过渡金属元素铁能形成多种配合物,如:K3[Fe(SCN)6][硫氰合铁(Ⅲ)酸钾]和Fe(CO)x等。
(1)①基态Fe3+的M层电子排布式为。
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x =。
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为。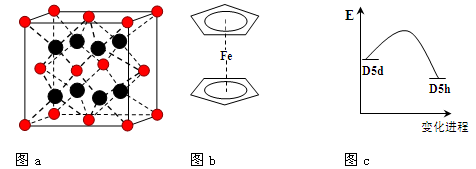
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键。二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种。
①二茂铁的分子式为。
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。因此每个环含有个π电子。
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8 ~ 20 kJ/mol。温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c。比较稳定的
是结构(填“重叠”或“错位”)。
【化学——选修2:化学与技术】海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用(写一点即可)。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是。
②A口排出的是(填“淡水”或“浓水”)。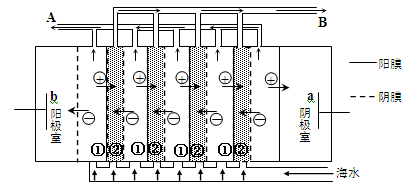
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: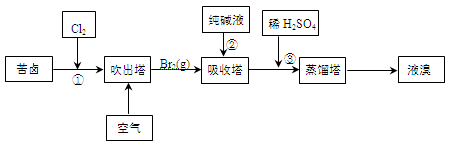
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是。
开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。
回答下列问题:
(1)反应②的化学方程式为。
(2)反应④的离子方程式为。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是(填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00 m3天然气理论上可制得氢气m3(同温同压条件下)。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物)。
①生成目标产物的电极反应式为。
②该储氢装置的电流效率为η=。(η=  ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,溶液的pH=。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为,由水电离出的c(OH-)=mol·L-1。
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则HX是(填“强酸”或“弱酸”),理由是。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为(填化学式)。
②25 ℃时,在0.5 mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的倍。
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b、c。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。