开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。
回答下列问题:
(1)反应②的化学方程式为 。
(2)反应④的离子方程式为 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 (填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为 。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00 m3天然气理论上可制得氢气 m3(同温同压条件下)。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物)。
①生成目标产物的电极反应式为 。
②该储氢装置的电流效率为η= 。(η=  ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
实验室用乙酸和正丁醇(CH3CH2CH2CH2OH)制备乙酸正丁酯。有关物质的相关数据如下表。
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备(图见右上)
在三孔圆底烧瓶中加入沸石、18.5 mL正丁醇和15.4 mL冰醋酸,再加3~4滴浓硫酸。然后安装分水器
(作用:实验过程中不断分离除去反应生成的水)、温度计及冷凝管(起回流作用),加热使之反应。反应时加热有利于提高酯的产率,但温度过高酯的产率反而降低,其可能的原因是:(答一点即可)
Ⅱ.乙酸正丁酯粗产品的精制
(1)①将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步操作的目的是②用分液法可分离上述有机层和水层,取出有机层的操作是
(2)将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在左右
Ⅲ.计算产率
称量制得的乙酸正丁酯的质量为12.76 g,则乙酸正丁酯的产率为
(14分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物。B、L、K 常温下为无色无味气体,I为有色有刺激性气味气体。G为黑色固体,F的焰色反应显紫色(透过钴玻璃观察)。反应⑤中,产物F、P的物质的量之比为1:1。各物质转化关系如下图: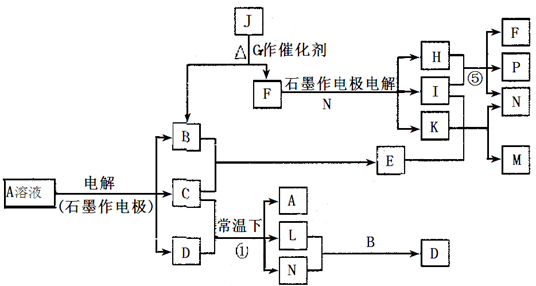
回答下列问题:
(1)P的电子式是_________;I所含元素在元素周期表中的位置是________________;
(2)写出反应①的离子方程式: ______________________________________________;
(3)M的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式说明原因:______________________________________________________________
(4)用惰性电极电解400.00mL A溶液,一段时间后测得溶液pH=1,此时需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下: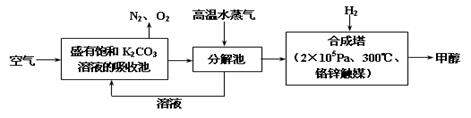
(1)上述流程中碳酸钾溶液所起的作用是:;
(2)分解池中反应的化学方程式为;
(3)在合成塔中,若有4.4 kg CO2与足量H2恰好完全反应,生成气态的水和甲醇气体,可放出4947 kJ
的热量,试写出合成塔中发生反应的热化学方程式:
;
(4)从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用300℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是;
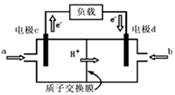
(5)右图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH + 3O2=2CO2 + 4H2O则:a处通进的物质是(写名称);电极d的名称是极;电极c处发生的电极反应方程为:。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。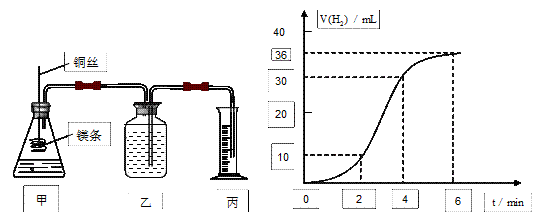
图1图2
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在下图的方框中画出上述反应的速率与时间的关系曲线。(请在图上标明相应的数值)
|
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。


 (1)已知:2NO2(g)===N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
(1)已知:2NO2(g)===N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
N2O4(g)达到平衡。 其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=kJ·mol-1。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=kJ·mol-1。 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。则反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。则反应2NO2(g) N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=