(18分)(一)按要求作答:
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为: 。
(2)3d能级为半充满的正三价离子,该离子的电子排布式为 。
(二)A、B、C、D、E五种元素为1~18号元素。已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:
| |
甲 |
乙 |
丙 |
丁 |
| 化合物中各元素原子个数比 |
A和C 1∶1 |
B和A 1∶2 |
D和E 1∶3 |
B和E 1∶4 |
(1)E-的结构示意图是________________。B原子核外有________个未成对电子,它们的能量______________(填“相等”或“不相等”)。
(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是____________________。
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为___________。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是____________________。
(10分)
(1) 已知:0.4 mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,放出256.65 kJ的热量.
①反应的热化学方程式为:____________________________________________.
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______________________________________________________________.
(2)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)===C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(l)ΔH=-c kJ/mol
2H2(g)+O2(g)===2H2O(l)ΔH=-d kJ/mol
请回答下列问题:
①等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
②C3H8(g)===C3H6(g)+H2(g)的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量,.
③b与a、c、d的数学关系式是_____________________________________.
(12分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容 仪器A中
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用(填序号)
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是否用酸式滴定管还是用碱式滴定管,理由是
(3)能否用水代替苯,理由 是。
(4)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm(如下图),则用上述方法测得的阿佛加德常数NA的表达式为NA=mol-1。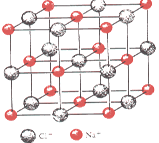

已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答
(1)组成A分子的原子的核外电子排布式是;
(2)B和C的分子式分别是和;C分子的立体结构呈形,该分子属于分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的电子式是,
该反应的化学方程式为;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是。
(8分)以下6种物质中选取序号填空(可重复选填)。
①二氧化碳 ②硫化氢 ③氯化铵 ④氢氧化钾 ⑤甲醛 ⑥乙醇
(1)含有非极性键的是________;(2)含有配位键的是________;
(3)既含有σ键又含有π键的是________;(4)属于非极性分子的是________;
(5)分子的立体结构呈平面三角形的是________;(6)属于离子晶体的是________。
某实验小组用下列装置进行乙醇催化氧化的实验。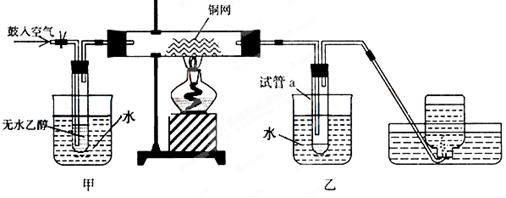
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、.
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是加热;乙的作用是。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有另一种杂质,
要除去该杂质,可在混合液中加入(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填试验操作名称)即可除去。