(12分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容 仪器A中
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用 (填序号)
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是否用酸式滴定管还是用碱式滴定管 ,理由是
(3)能否用水代替苯 ,理由 是 。
(4)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm(如下图),则用上述方法测得的阿佛加德常数NA的表达式为NA= mol-1。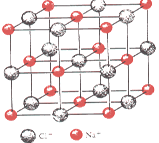

某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,则电流计指针偏向(填“铝”或“铜”)。铝片上的电极的反应式为;
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,则电流计指针偏向(填“铝”或“铜”),铝片为极(填“正”或“负”)。铜极上电极反应式为:,正极上发生的电极反应式为;
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为。
通过上述实验探究,你受到的启示是。
下图为A、B、C、D、E五种物质的相互转化关系,请按如下要求填空: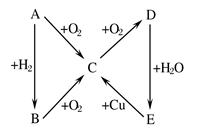
(1)若A是气体单质,则A的结构式为,B的电子式为,由D生成E的反应的化学方程式是;
(2)若A为固体单质,则A元素在元素周期表中的位置是在第周期第族,由E生成C的反应的化学方程式是。
下列物质①铁②干冰③金刚石④铜⑤水晶⑥氯化钠⑦单质碘⑧氢氧化钠【请用编号回答(1)和(2)小题】
(1)属于离子晶体的是,属于分子晶体的是,属于原子晶体的是,属于金属晶体的是;
(2)只含共价键(不含分子间作用力)的化合物是,只含离子键的是,既含共价键又含离子键的是;
(3)写出电子式:干冰,氢氧化钠。
(4)写出结构式:干冰,单质碘
在浓硝酸中放入铜片:
(1)反应开始时,实验现象为。
反应的化学方程式为;
(2)反应结束后,若铜有剩余,反应接近结束时的化学反应方程式为:
;
某化学兴趣小组同学进行如下实验。
(1)使用铜和稀硫酸制备硫酸铜晶体。步骤如下: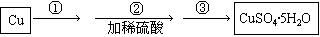
步骤①观察到的现象是:。
步骤③的主要操作包括:。
(2)某同学查资料知:铜与稀硫酸不反应,若在稀硫酸中加入H2O2,铜可逐渐溶解。实验装置如图,写出该反应的化学方程式:。
(3)铜粉放入稀硫酸中,加热后无明显现象发生。当加入一种物质后,铜粉开始溶解,溶液变蓝色,同时有气体逸出,该物质是(填字母);
| A.Al2(SO4)3 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
写出该反应的离子方程式。