【化学——选修3:物质结构与性质】过渡金属元素铁能形成多种配合物,如:K3[Fe(SCN)6][硫氰合铁(Ⅲ)酸钾]和Fe(CO)x等。
(1)①基态Fe3+的M层电子排布式为 。
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因 。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x = 。
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为 。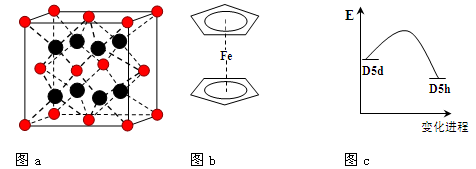
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键。二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种。
①二茂铁的分子式为 。
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。因此每个环含有 个π电子。
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8 ~ 20 kJ/mol。温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c。比较稳定的
是 结构(填“重叠”或“错位”)。
碳是形成化合物种类最多的元素。
(1)CH2=CH-C≡N是制备腈纶的原料,其分子中 键和
键和 键的个数之比为__________(填最简整数比);
键的个数之比为__________(填最简整数比);
(2)乙醇CH3CH2OH与甲醚CH3OCH3的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是____________________;
(3)某元素位于第4周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_______________.
(6分)下图是某化学兴趣小组同学模拟石蜡油(液态烷烃混合物)深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程:
请回答下列问题:
(1)A的结构简式为_________________;(2)B中所含官能团的名称是___________________;
(3)写出下列反应的化学方程式:
①B+丙烯酸 丙烯酸乙酯___________②苯
丙烯酸乙酯___________②苯 硝基苯____________________
硝基苯____________________
(10分)海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是_____________(填序号);
| A.Cl2 | B.淡水 | C.烧碱 | D.粗盐 |
(2)下图是从海水中提取镁的简单流程。
工业上常用于沉淀 Mg2+的试剂A的名称是__________,,Mg(OH)2转化为MgCl2离子方程是_________海水经蒸发浓缩析出NaCl晶体后的溶液成为卤水,卤水中含有NaBr等无机盐,某实验小组同学设计如下实验流程,模拟工业上从卤水提取工业溴。
①操作I中所涉及到的离子反应方程式为____________.
操作II中所涉及到的化学反应方程式为____________.
②操作II用SO2水溶液吸收Br2,吸收率可达95%,由此反应可知,除环境保护外,在工业生产中还应解决的主要问题是_____________.
③实验小组的同学通过实验发现,如果用未经浓缩的海水直接与Cl2反应,生成的Br2的量会大幅度降低,请你根据所学知识分析原因:_______________________________________.
砷(As)广泛分布与自然界,砷与氮同主族,比氮多两个电子层。
(1)砷位于元素周期表中_____周期________族,其气态氢化物的稳定性比NH3_______(填“强”或“弱”);
(2)砷的常见酸性氧化物有As2O3和As2O5,请根据图中信息写出As2O3分解为As2O5的热化学方程式:________________________;
(3)已知:将酸滴入砷酸盐与KI混合的溶液中发生反应:AsO43-+2I―+2H+=AsO33-+I2+H2O.某研究性学习小组同学欲利用该反应原理,设计实验装置探究原电池原理,请你配合他们绘制原电池装置图,并回答下列问题:
若以石墨为电极,正极上发生的反应为______________.该电池工作时,当外电路中转移5mol电子时,则有_________molI2生成.
工业制氢气的一个重要反应是:CO(g)+H2O(g)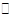 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25。C时:
①C(石墨)+1/2O2(g)=CO(g)△H1=-111kJ·mol-1
②C(石墨)+O2(g)=CO2(g)△H2=-394kJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-242kJ·mol-1
则反应CO(g)+H2O(g) ="==" CO2(g)+H2(g)的反应热△H=___________.
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: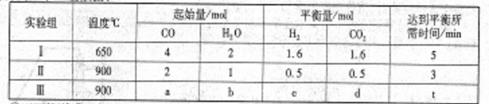
①以下反应能说明CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________
| A.容器中CO的含量保持不变 | B.容器中CO2浓度与CO浓度相等 |
C.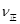 (CO)= (CO)=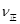 (H2O) (H2O) |
D.容器中混合气体的平均相对分子质量保持不变 |
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率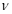 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时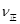 ___________
___________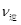 (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)