有10.2克镁铝合金恰好溶于250mL 4mol·L-1的盐酸中,现加入2mol·L-1的氢氧化钠溶液。请回答:
(1)要使产生的沉淀的质量最大,需加入的氢氧化钠溶液的体积是 mL
(2)要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积是 mL
若 B1和 B2常温混合后,碳氧质量比总小于 3∶8时,B1、B2必须满足的关系是n(B1)∶n(B2)______。
混合气体中有 A 的形成过程。
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
蓝色黄色
试回答下列问题:
(1)欲使溶液由黄色变为蓝色,可采取的两种方法为:①;②。
(2)欲使溶液由蓝色变为绿色,可采取的两种方法为:①;②。
(1)写出一个以离子浓度表示的电荷守恒等式:。
(2)写出一个含有c(OH-)和c(H+)的等式:。
(3)根据Na3PO4中Na、P原子个数关系,写出一个含有c(Na+)和c(PO )的等式:。
)的等式:。
(1)根据电荷守恒,写出一个用离子浓度表示的等式:;
(2)根据水的电离,写出一个含有c(H+)和c(OH-)的等式:;
(3)根据(NH4)2CO3中,C、N原子个数关系,写出一个含有c(NH+4)和c(CO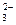 )的等式:。
)的等式:。