某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图
所示的变化。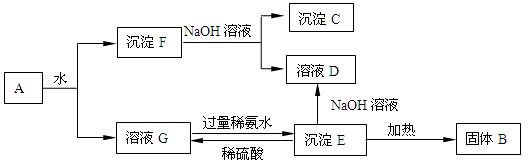
请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是 。
(2)B、C、D、E 4种物质的化学式为:
B 、C 、D 、E 。
(3)沉淀F与NaOH溶液反应的离子方程式为 。
沉淀E与稀硫酸反应的离子方程式为 。
溶液G与过量稀氨水反应的化学方程式为 。
回答下列问题
(1)向一体积不变的密闭容器中加入2molNO2气体,发生反应2NO2(g)  N2O4(g),反应达平衡后,N2O4的体积分数为a,在温度不变的条件下,再向该容器加入1molN2O4气体,反应重新达平衡后,N2O4的体积分数为b,则a_____________b(填“>”“=”“<”,)
N2O4(g),反应达平衡后,N2O4的体积分数为a,在温度不变的条件下,再向该容器加入1molN2O4气体,反应重新达平衡后,N2O4的体积分数为b,则a_____________b(填“>”“=”“<”,)
(2)已知胆矾溶于水时溶液温度降低.胆矾分解的热化学方程式为________________
CuSO4•5H2O(s)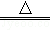 CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1 Q2(填写>,=或<)
CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1 Q2(填写>,=或<)
(1)写出醋酸的电离方程式:__________________________。
(2) 下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加入少量冰醋酸
c.加入少量氯化钠固体
d.加热CH3COOH溶液
e.加入Zn粒
f.加入少量0.10 mol·L-1的CH3COONa溶液
(3)若25℃时,在0.5 L 0.2 mol·L-1的CH3COOH溶液中,有0.01 mol的CH3COOH电离成离子。该温度下CH3COOH的电离常数K=_____________。
铜是过渡元素。化合物中,铜常呈现+1价或+2价。
(1)铜原子的原子结构示意图: ;
(2)右图为某铜矿晶体结构单元,该铜矿的化学式为 。
(3)已知,铜的第一电离能为746kJ·mol-1,第二电离能为1958kJ·mol-1。请结合核外电子排布相关知识解释,铜第二电离能远远大于第一电离能的原因: 。
(4)对于CuX(X为卤素)而言,铜与X形成的化学键极性越强,对应的CuX的溶解度越大。据此可知,CuCl的溶解度比CuI的溶解度__________(填“更大”或“更小”);
(5)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。
①[Cu(NH3)n]+中n =______________________;
②[Cu(NH3)n]+中Cu+与n个氮原子构成的空间结构呈 型;
③[Cu(NH3)n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO。加热分解放出CO的过程中,必须克服微粒间的作用力是 。
(6)+2价铜的氢氧化物难溶于水,但可溶于浓氨水形成配位数为4的配合物。写出氢氧化铜溶解于浓氨水的离子方程式 。
某班学生对BeCl2是离子化合物还是共价化合物进行集体探究,从经验看铍是金属元素,易失去电子,氯元素易得到电子,请回答以下问题:
(1)Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 化合物。
(2)工业上制取BeCl2方法是:将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式 。
(3)经实验验证,熔融的BeCl2不能导电,说明它是 化合物;BeCl2能溶于水,水溶液能导电,因它在溶液中能电离,写出它的电离方程式 。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,判断BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(5)0.1mol氢氧化铍恰好能和100mL0.2mol/L的氢氧化钠溶液发生反应,写出反应的化学方程式 。
下表是元素周期表的一部分,表中列出了8种元素在周期表中的位置。请回答有关问题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
⑤ |
⑥ |
⑦ |
||||
| 3 |
② |
④ |
|||||
| 4 |
① |
③ |
⑧ |
(1)写出元素⑧的基态原子核外电子排布式 ;
(2)元素⑤⑥⑦第一电离能由大到小的顺序是 (用电离能和元素符号表示);
(3)元素①、②、③对应的氧化物熔点由高到低的顺序排列是 (填化学式);
(4)元素③、②、④形成的单质晶体的熔点升高的原因是 。