铜是过渡元素。化合物中,铜常呈现+1价或+2价。

(1)铜原子的原子结构示意图: ;
(2)右图为某铜矿晶体结构单元,该铜矿的化学式为 。
(3)已知,铜的第一电离能为746kJ·mol-1,第二电离能为1958kJ·mol-1。请结合核外电子排布相关知识解释,铜第二电离能远远大于第一电离能的原因: 。
(4)对于CuX(X为卤素)而言,铜与X形成的化学键极性越强,对应的CuX的溶解度越大。据此可知,CuCl的溶解度比CuI的溶解度__________(填“更大”或“更小”);
(5)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。
①[Cu(NH3)n]+中n =______________________;
②[Cu(NH3)n]+中Cu+与n个氮原子构成的空间结构呈 型;
③[Cu(NH3)n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO。加热分解放出CO的过程中,必须克服微粒间的作用力是 。
(6)+2价铜的氢氧化物难溶于水,但可溶于浓氨水形成配位数为4的配合物。写出氢氧化铜溶解于浓氨水的离子方程式 。
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如右图:
(1) 原料A的名称是____,步骤①反应的离子方程式是_________________。
(2) 滤液1中要加入稍过量原料B,原料B的化学式是__,步骤②反应的离子方程式是
(3) 步骤③的化学方程式是:_____________________________________________。
(4) 如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响__________________________________________________。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应
方程式:。若要确认其中有Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为: 。
。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为。
小伶同学某日的食谱为:
早餐——鸡蛋1个,包子2个,牛奶1瓶;
午餐——米饭100g,炸鸡腿70g,炒五花肉50g,煎蛋50g;
晚餐——米饭100g,烤鸭80g,,清蒸福寿鱼120g,虾酱炒番薯叶50g。
①在这些食物中,富含蛋白质的是(各举一例即可),富含油脂的是,富含植物纤维素的是,富含淀粉的是的;
②纤维素(能/不能)被人体消化,它对人体中的主要作用是;
③小伶的食谱中,是(酸/碱)性食物为主;
(每空2分,共18分)在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+ B(g)2C(g);△H=QkJ/mol
B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
 实验 实验序号 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc=mol/(L·min);实验2中采取的措施是;实验3中n31.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_0(填“>、=、<”),理由是_
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示,根据图中所示判断下列说法正确的____。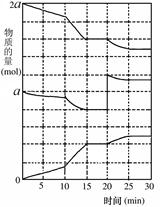
a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始
(g)和3molB(g),此时容器的压强为P(始 )。
)。
反应进行并达到平衡后,测得容器内气体压强为P(始)的 。若相同条件下,向上述
容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压
强仍为P(始)的 。
①a、b、c必须满足的关系是,。
(一个用a、 c表示,另一个用b、c表示)
c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是。
(每空2分,共14分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸
(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是____________。
(用a、b、c表示,下同)
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是____________。
(3)当三者c(H+)相同时,物质的量浓度由大到小的顺序是____________。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的 体积由大到小的顺序是____________。
体积由大到小的顺序是____________。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为____________。反应所需时间的长短关系是______________。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。