(共15分)化学是以实验为基础的学科,检查装置气密性是化学实验中的重要操作之一。请按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是________(填序号,下同).
A.容量瓶 B.洗气瓶 C.分液漏斗 D.酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致不良后果的叙述中,正确的是________.
A.收集不到气体 B.造成环境污染
C.观察到的实验现象有误 D.引发爆炸事故
(3)为检查如图所示简易气体发生装置的气密性,甲同学进行了以下操作和方案设计。甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好。经检验他的方案可行。请补充完善甲同学的操作方案、现象和结论:____ _____。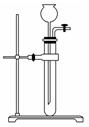
(4)化学实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(5)图是某同学在配制150 mL 0.2 mol/L NaCl溶液时转移溶液的示意图,图中的两处错误是:_________________、____________________。
若在定容时仰视,则所配溶液的浓度_________(填“偏高、偏低、不影响”)。若定容不慎超过刻度线,应采用的处理方法是:__________________。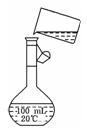
实验室常用加热铵盐和碱的固体混合物的方法制取氨气。
根据下图回答问题: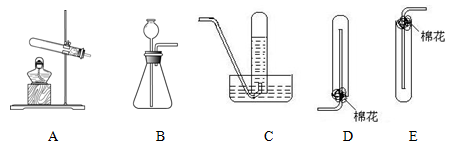
(1)实验室制取氨气的发生装置为(填序号),该反应的化学方程式为。
(2)下列气体可以用与氨气相同的收集装置收集的是(填序号)。
A. H2 B. CO2
氯气是一种化学性质活泼的气体。
⑴氯气是一种具有气味的气体,密度比空气的(填“大”或“小”),若采用图中装置收集氯气,则氯气应由管(填“A”或“B”)通入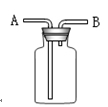
⑵氯气与NaOH溶液反应的化学方程式为,该反应可用于工业上制取漂白液,其有效成分是。
(11分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。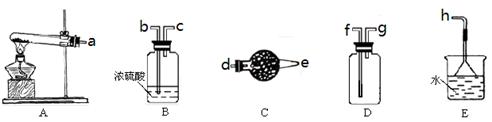
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接,接,接h;
用A装置制取NH3的化学反应方程式为
(2)用下图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用(选填字母编号);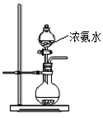
| A.碱石灰 | B.生石灰 | C.无水氯化钙 | D.无水硫酸铜 E、烧碱 |
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是,试写出制纳米级碳酸钙的化学方程式;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: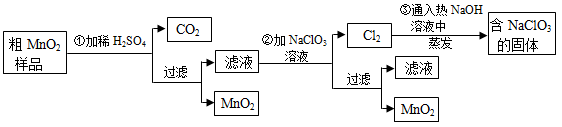
(1)第①步加稀H2SO4时,粗MnO2样品中的(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是:
+ClO3—+=MnO2↓+Cl2↑+。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、玻璃棒。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0、224LCO2(标准状况下),则在第①步反应中至少需要mol H2SO4。
(已知摩尔质量:MnO2 -87g/mol; MnO-71g/mol; MnCO3-115 g/mol)
某化学探究学习小组设计如下图装置制取硝酸。(图中的夹持和加热仪器均已略去)
实验中可供使用的药品有:Na2CO3、NaHCO3、(NH4)2CO3、NH4HCO3、Na2O2、NaOH溶液、水。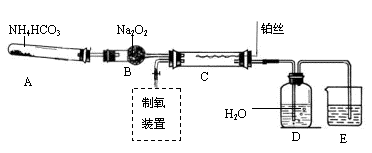
请回答下列问题:
(1)装置C中发生反应的化学方程式是 。装置D中发生反应的化学方程式是 。
(2)撤去装置C中的加热装置后,铂丝仍然保持红热,这是因为: 。
(3)实验过程中,要使NH4HCO3充分转化为HNO3,还要在装置C中通入氧气。利用上述药品制取氧气,可以选用下列装置中的 。(填序号)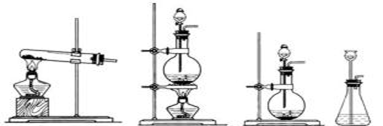
① ② ③ ④
(4)装置E中盛放的是 溶液,其作用是 。
(5)实验中,为了省略制氧气的装置,可以在A中再加入上述提供药品中的一种物质,它是 。