已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/mol·L—1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5 min内,消耗N2的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)="1.60mol" ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| |
N2 |
H2 |
NH3 |
| 起始浓度(mol/L) |
0.2 |
0.3 |
0.2 |
| 平衡浓度(mol/L) |
a |
b |
c |
请回答:
①各物质的平衡浓度可能是_______________.
A.c="0.5mol/L " B.b="0.5mol/L " C.c="0.4mol/L " D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)  4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“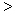 ”、 “
”、 “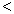 ”或“=”), △H=_____________。
”或“=”), △H=_____________。
(已知:H2的燃烧热为285.8 kJ/mol)
世界是物质的,物质是由各种化学元素组成的,请你写出下列物质的化学式:
(1)“西气东输”工程中输送的气体是;
(2)水银不是银,是一种金属的俗称,这种金属是;
(3)既可用来消毒杀菌,又可用来改良酸性土壤的碱是;
(4)氧元素的质量分数最多的氧化物是。
某校实验小组的同学用实验的方法区别稀盐酸和稀硫酸钠溶液(记作M、N),请你一同参与。
⑴甲组同学向M、N中分别加入少量的铁粉,观察到M中产生大量无色气泡,则M中发生反应的化学方程式为。
⑵乙组同学向M、N中分别滴加Na2CO3溶液,发现M也有无色气泡产生,N没有气泡产生,则M中发生反应的化学反应方程式为。
⑶丙组同学向M、N中分别加入滴加BaCl2溶液,N中出现的现象是。
⑷丁组同学用了下列试剂中的一种也将M、N区别开来,这种试剂是(填序号)
①酚酞试液②硫酸铜溶液③氯化钠溶液④pH试纸
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产物已略去):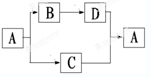
(1)若A是一种白色难溶于水的钙盐,由三种元素组成,C 是大气循环循环中的一种重要物质.则B的化学式是 ,C和D反应生成A的化学方程式是 。
(2)若A是无色液体,D是一种黑色固体.则C的化学式是 ,由B生成D的化学方程式为 。
(3)若A是碳酸氢钠,且已知碳酸氢钠受热可分解为碳酸钠、二氧化碳和水.写出过量的气体C与D溶液反应生成A的化学方程式 。
如右图所示,弹簧秤下挂着一重物A,烧杯中盛有溶液B,试根据要求回答下列问题: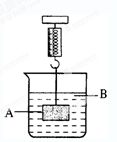
(1)若A为铝块,B为稀硫酸,将A放入B中,过一会儿,弹簧秤的读数将(填“变大”“变小”或“不变”),反应的化学方程式为。
(2)若A为铁块,B为硫酸铜溶液,将A放入B中,过一会儿,弹簧秤的读数将(填 “变大”“变小”或“不变”),反应的化学方程式为。
我国西部大部分山区的许多村庄,仍以饮用未经任何处理的地表水为主,这些地表水受到不同程度的污染,对山区群众的身体健康造成不利影响。目前国务院和各级政府投入大量资金,采取积极措施为这些村庄建水厂、安装自来水管道,让群众喝上清洁、卫生的水。
(1)硬水可用 来区分。硬水中含有较多可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦。生活中可用 来降低水的硬度.
(2)硬水在加热或久置时,会产生水垢[主要成分是Mg(OH)2和CaCO3],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式: 、 .
⑶自来水生产过程中,可用方法除去水中不溶性杂质,同时还必须进行消毒杀菌。ClO2是一种新型的自来水消毒剂,其中氯元素与氧元素的质量比为:,氯的原子结构示意图为。