锂和铍单质及化合物的性质具有特殊性。
I.石墨可以用作锂电池的负极材料,Li+嵌入石墨层间,形成LiC6嵌入式化合物,正极材料常用LixCoO2。
(1)电负性Li Be(填“>”或“<”)。
(2)Co元素基态原子核外价电子排布式为 。
(3)在LiC6中,Li+与相邻石墨六元环的作用力类型为 。
II.固体氯化铍结构如图: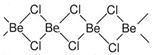
(4)铍原子杂化轨道类型为 。
(5)氯化铍分子中含有化学键类型有 (填序号)。
| A.极性键 | B.非极性键 | C.配位键 | D.离子键 |
(1)写出离子方程式:
硫酸钠溶液与氯化钡溶液
铝片与硝酸汞溶液。
(2)写出与下列离子方程式相对应的化学方程式:
H+ + OH-= H2O
Cu2+ + Fe=" Cu" + Fe2+。
(6分)今有10种物质:①石墨、②硫酸钡、③盐酸、④氨气、⑤石灰水、⑥氢氧化镁、⑦熔融NaCl、⑧蒸馏水、⑨二氧化硫、⑩固体氧化钠。其中:(填序号)
(1)属于电解质的是。
(2)属于非电解质的是。
(3)能导电的是。
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:
C6H5C2H5(g) C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1
C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1
(1)该反应的平衡常数表达式为K= __ _____________。随着温度的升高,K值________(填“增大”、“减小”或“不变”,下同)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。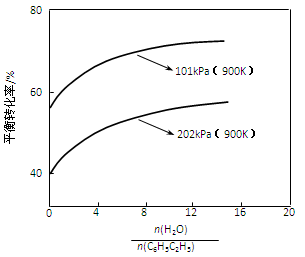
①由上图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______;
结论二:__________________________________________________。
②加入稀释剂能影响C6H5C2H5平衡转化率的原因是:_______________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因:_______________________________________________。
(16分)(1)反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
①升温____________;②增大压强____________;③增大容器容积____________;
④加入A____________;⑤加入B____________;⑥加正催化剂____________。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________________________________________。
(3)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g)△H1="+156.6" kJ·mol-1
CH(g)+H2(g)△H1="+156.6" kJ·mol-1
CH3CH CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC CH(g )△H2="+32.4" kJ·mol-1
CH(g )△H2="+32.4" kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH CH2(g)+H2(g) 的△H=kJ·mol-1。
CH2(g)+H2(g) 的△H=kJ·mol-1。
(4)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 |
C—H |
C—F |
H—F |
F—F |
| 键能 |
414 |
489 |
565 |
158 |
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g)△H=______________________
在一定条件下,可逆反应:mA+nB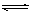 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。