燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对 燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 ▲ 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) 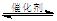 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800  K K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①若温度升高,则反应的平衡常数K将 ▲ (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 ▲ 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
▲ 。
③在②所确定的电池中,若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 ▲ g。
航天技术上使用的氢氧燃料电池具有高能、轻便、不污染环境等优点。氢氧燃料电池有酸式和碱式两种。它们放电时的电池总反应式均可表示为2H2+O2====2H2O。酸式氢氧燃料电池中的电解质是酸,其负极反应可表示为2H2====4H++4e-,则其正极反应可表示为_____________________,碱式氢氧燃料电池中的电解质是碱,其正极反应可表示为O2+2H2O+4e-====4OH-,则其负极反应可表示为______________________________。
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极燃气,制得在650 ℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:2CO+2
 4CO2+4e-
4CO2+4e-
阴极反应式为_____________________,总电池反应为_______________________、还原剂是________________。
(6分)在铜、银和硝酸银构成的原电池工作时,正极为__________________;当有1.6 g铜溶解时,银棒增重__________________。
下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
(1)Zn+Ag2O+H2O Zn(OH)2+2Ag____________________________________________。
Zn(OH)2+2Ag____________________________________________。
(2)2C2H2+5O2 4CO2+2H2O__________________________________________________。
4CO2+2H2O__________________________________________________。
(3)6H2O+6CO2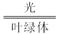 C6H12O6+6O2______________________________________________。
C6H12O6+6O2______________________________________________。
(4)CaCO3 CaO+CO2↑______________________________________________________。
CaO+CO2↑______________________________________________________。
某反应是吸热反应,且所吸收的热能由外部热源(如酒精灯)提供,提供的热能主要起到的作用是
__________________________________________________________________________。