现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Ag+ Ba2+ A13+ |
| 阴离子 |
OH- C1- SO42- |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不容于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀。
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化 学式:A ,C
学式:A ,C  ,
,
D ,E 。
(2)A溶液与过量的E溶液反应后,最终得到沉淀的化学式是 。
北京市规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
Ⅰ.用天平准确称取5.0 g食盐样品,加适量蒸馏水使其完全溶解。
Ⅱ.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
Ⅲ.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液3.0 mL,恰好反应完全。
(1)步骤Ⅱ中反应后碘元素以形式(填物质的化学式)存在。
(2)已知步骤Ⅲ中S2O32-反应后转化为S4O62-,写出步骤Ⅲ的离子方程式。
(3)上述实验样品中碘含量是mg/kg。
现有含NaCl、Na2SO4、Na2CO3和NaHCO3的固体混合物。某同学为测定其中各组分的含量,取部分样品溶于水,并设计了如下实验流程(所加试剂均为过量,反应①~③均为复分解反应)。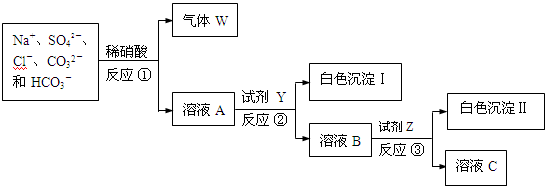
请回答: (1)气体W的化学式是。
(1)气体W的化学式是。
(2) 溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有。
溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有。
(3)反应②和③之后均需进行的操作的名称是。
(4)试剂Y是(填化学式)。
(5)测定各组分的含量,需要测的数据有:混合物总质量、白色沉淀Ⅰ和Ⅱ分别的质量和 。
有以下物质:①Mg②Al③C④稀硫酸⑤浓硫酸⑥NaOH溶液
(1)写出①与④反应的离子方程式。
(2)既能跟④又能跟⑥反应的是(填序号),写出它与⑥反应的化学方程式。
(3)写出写出③与⑤反应的化学方程式,下列关于该反应中⑤体现的性质说法正确的是。
a.既体现氧化性又体现酸性
b.只体现氧化性
c.只体现酸性
d.体现吸水性
现有下列4种物质:①SO2、②NO2、③FeCl2溶液、④NaHCO3溶液。其中,常温下为红棕色气体的是(填序号,下同);可使品红溶液褪色的是;焰色反应呈黄色的是;与氢氧化钠溶液反应,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色的是。
反应Cu + Cl2 CuCl2中,化合价升高的是(填元素符号),氧化剂是(填化学式),被氧化的物质是(填化学式);若反应中消耗了2 mol Cu,则生成mol CuCl2。
CuCl2中,化合价升高的是(填元素符号),氧化剂是(填化学式),被氧化的物质是(填化学式);若反应中消耗了2 mol Cu,则生成mol CuCl2。