下表是元素周期表前四周期的一部分,X、Y、Z、R、Q、W、J是7种元素的代号。回答下列问题时,涉及元素书写的请用相应的元素符号。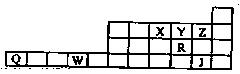
(1)J基态原子的核外电子排布式为 。基态Q2+中未成对电子数为 ;R和Y的简单离子与Na+三种离子的半径大小顺序为 。
(2)X、Y、Z三种元素电负性由大到小的排序是 ;X与Y的第一电离能:X Y(填“<”“>”或“=”),其理由是 。
(3)检验某溶液中是否含有Q3+的方法是 。
(4)已知WX3是一种引爆剂,受撞击时分解为两种单质,则其化学方程式为
。
(5)化学家直到1971年利用XeZ2(Xe为氙)和含JY—3的溶液反应才制得JY-4。反应中除生成JY-4外,还得到了Xe和一种弱酸。写出该离子反应方程式并标出电子转移方向和数目: 。
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4= ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。 (1)②中使用的氧化剂最好是下列的(填序号),理由是。
(1)②中使用的氧化剂最好是下列的(填序号),理由是。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |
(2)写出反应④的离子方程式:。
(3)为了达到综合利用、节能减排的目的,上述流程中步骤产生的可以用于步
骤(其中步骤选填①、②、③、④、⑤)。
Ⅱ.BaS溶液的制备 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
C(s)+ —O2(g)=CO(g); △H = —110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s);△H = —460 kJ•mol-1
(4)煅烧还原的热化学方程式为: 。
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
v(正)v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
 (4)若以右图所示装置,用电化学原理生产硫酸,写
(4)若以右图所示装置,用电化学原理生产硫酸,写
出通入O2电极的电极反应式为。
(1)已知1mol葡萄糖完全燃烧放热2800kJ。写出葡萄糖燃烧的化学反应方程式:___________________________________________________。现有72g葡萄糖(C6H12O6)与足量的氧气充分反应,共放热______________kJ。
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示(电解质溶液为酸性),试写出该电池的两极反应式:_______________________________________________________质子在交换膜上向_________(填正或负)极区迁移。72g葡萄糖在该电池中可转移电子__________mol。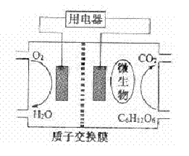
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)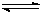
CH3OH(g)。图1表示反应进行过程中能量的变化(曲线a未使用催化剂,曲线b使用催化剂),图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。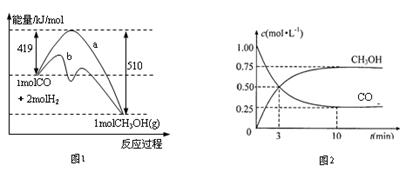
(1)下列说法正确的是______________
| A.反应进行到3min时达到化学平衡状态 |
| B.是否使用催化剂对反应前后的能量变化没有影响 |
| C.当反应物消耗量一定时,若反应生成液态甲醇,能量变化值会更大 |
| D.平衡时氢气的浓度为1mol/L |
(2)从反应开始到平衡状态,用CO浓度变化表示的反应速率为_______________,H2的转化率为______________。
(3)当有0.25mol CH3OH生成时会__________(填吸收或放出)___________kJ的热量。
已知X、Y、Z、W四种元素是元素周期表中三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。试推断:
(1)X、Y、Z、W四种元素的符号:X、Y、Z、W。元素Z在周期表中的位置是______________________。
(2)由以上元素中的两种元素组成的化合物,溶于水后水溶液显碱性,该化合物的电子式分别为、(任写2种)。
(3)由X、Y、Z所形成的共价化合物(Y呈最高价)是,离子化合物是。(均写化学式)
(4)由X和Y两种元素组成的18电子的分子为__________(写分子式),该分子中所有原子都已达到类似于稀有气体原子的稳定结构,则其结构式为__________。