⑴向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子恰好沉淀完全时,溶液PH 7 (填﹥、﹤或=),离子反应总方程式为 。
(2)向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子恰好沉淀完全时,溶液PH 7 (填﹥、﹤或=),离子反应总方程式为 。
实验室制备乙酸乙酯的原理是:
CH3CH2OH+CH3COOH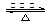 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
为了得到更多的乙酸乙酯常采用如下措施,
①原料选择无水乙醇和冰醋酸,而不是乙醇溶液或是醋酸溶液,其依据是____________;
②通过控制反应温度,尽可能地将生成的乙酸乙酯从反应体系中脱离,有利于乙酸乙酯的生成,其依据是__________;
已知拆开1mol H-H键、1molN≡N和1mol N—H键分别需要的能量是436kJ、 948kJ、391 kJ。则N2、H2合成NH3的热化学方程式为:。
4g CO在氧气中燃烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学方程式为。
氨气是生产化肥、硝酸的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g)ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g)ΔH =" -92.4" kJ/mol
2NH3 (g)ΔH =" -92.4" kJ/mol
计算断裂1 mol N≡N键需要能量kJ , 氮气分子中化学键比氧气分子中的化学键键(填“强”或“弱”),
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:
3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| N2 |
H2 |
NH3 |
|
| 甲 |
1 |
3 |
0 |
| 乙 |
0.5 |
1.5 |
1 |
| 丙 |
0 |
0 |
4 |
①判断乙容器中反应进行的方向。(填“正向”或“逆向”)
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为。
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al的原子结构示意图为;Al与NaOH溶液反应的离子方程式为
。
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为。
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g)△H<0
Si3N4(s) + 12HCl(g)△H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是mol/(L·min)。
②平衡时容器内N2的浓度是mol·L-1。
③SiCl4(g)的转化率是。
④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应(填“增大”、“减”或“不变”)。
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)