以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
B .28gCO中所含的原子数为2NA
.28gCO中所含的原子数为2NA
C.0.1mol/LNa2CO3溶液中,含有CO32— 数为0.1NA
D.标况下,22.4L苯的分子数为NA
某化学反应其△H=-122 kJ/mol,∆S=231 J/(mol·K),则此反应在下列哪种情况下可自发进行
| A.在任何温度下都能自发进行 | B.在任何温度下都不能自发进行 |
| C.仅在高温下自发进行 | D.仅在低温下自发进行 |
化学反应N2+3H 2= 2NH3的能量变化如图所示,该反应的热化学方程式是
2= 2NH3的能量变化如图所示,该反应的热化学方程式是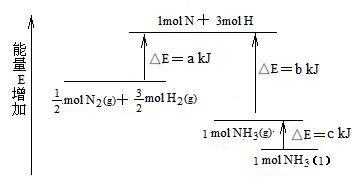
| A.N2(g)+3H2(g) = 2NH3(l);⊿H = 2 (a—b—c) kJ·mol-1 |
B. N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2 (b—a) kJ·mol-1 N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2 (b—a) kJ·mol-1 |
C.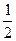 N2(g)+ N2(g)+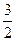 H2(g) = NH3(l) ;⊿H = H2(g) = NH3(l) ;⊿H = (b+c—a) kJ·mol-1 (b+c—a) kJ·mol-1 |
D.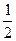 N2(g)+ N2(g)+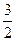 H2(g) =NH3(g) ;⊿H = (a+b) kJ·mol-1 H2(g) =NH3(g) ;⊿H = (a+b) kJ·mol-1 |
已知下列热化学方程式:
(1)CH3COOH (l)+2O2 (g) ==2CO2 (g)+2H2O (l) ΔH1=-870.3 kJ·mol-1
(2)C (s)+ O2 (g) ==CO2 (g)△H2=-393.5 kJ•mol-1
(3)H2(g) +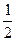 O2(g) ==H2O (l)△H3=-285.8kJ·mol-1
O2(g) ==H2O (l)△H3=-285.8kJ·mol-1
则反应2C (s)+2H2 (g) +O2(g) ==CH3COOH (l)的△H为
| A.-488.3 kJ·mol-1 | B.-244.15 kJ·mol-1 | C.+488.3 kJ·mol-1 | D.+244.15 kJ·mol-1 |
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);△H=-285.8 kJ / mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0 kJ / mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518 kJ / mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3 kJ / mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是
| A.H2(g) | B.CO(g) | C.C8H18(l) | D.CH4(g) |
下列说法 或表示法正确的是
或表示法正确的是
| A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
B.由C(石墨)→C(金刚石) ΔH =" +119" kJ·mol—1可知,金刚石比石墨 稳定 稳定 |
C.在稀溶液中:H++OH-==H2O ΔH  = -57.3 kJ· mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ = -57.3 kJ· mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ |
D.在101 kPa时,2 g H2完全燃烧 生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)==2H2O(l) ΔH =" +285.8" kJ· mol—1 生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)==2H2O(l) ΔH =" +285.8" kJ· mol—1 |