下列反应中,属于氧化还原反应的是
| A. CaO + H2O = Ca(OH)2 |
B. 2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
C. NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
| D.2NaOH+H2SO4==Na2SO4 + 2H2O |
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。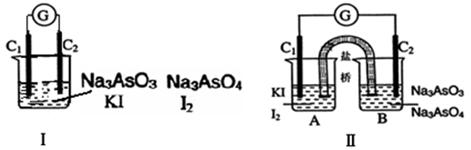
下列叙述中正确的是
| A.甲组操作时,微安表(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变深 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为I2 +2e-=2I- |
在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31
Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
| A.Fe3+ | B.Cr3+ | C.Zn2+ | D.Mg2+ |
已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
下列离子方程式书写正确的是
| A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-= BaSO4↓+H2O |
| B.NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O= Fe(OH)2↓ + 2HClO |
| C.NH4HSO3溶液与足量NaOH溶液反应:NH4+ + OH-= NH3↑ + H2O |
| D.将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合: |
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
设NA表示阿伏加德罗常数,下列叙述正确的是
| A.71 g氯气被还原得到的电子数为2NA |
| B.100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA |
| C.标准状况下,2.24 L乙烯中含有的σ键数目为0.5 NA |
| D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA |