(6分)
某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
(1) 溶液中的H+物质的量取值范围是:
(2) 已知0.1mol·L-1NaHB溶 液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”,“>”,或“=”),理由是: 。
液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”,“>”,或“=”),理由是: 。
A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D,D和A形成简单离子后,它们的电子层相差两层,已知A处于第n族,D处于第m族,且A单质中含有共价键,B的气态氢化物的分子式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等,C和A形成CA3型化合物,C与A、B在同一周期,B与A左右相邻,试回答:
(1)C离子的结构示意图为[
(2)向B的氢化物的水溶液中滴入A单质的水溶液,发生反应的化学方程式为.
(3)向A、C形成的化合物的水溶液中滴入氨水,其反应的离子方程式为___________________
有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛 的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):
的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):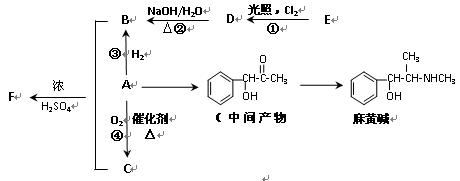
请回答下列问题:
(1)下列关于麻黄碱的说法正确的是(填字母)。
a.麻黄碱的分子式为C10H15NO b.麻黄碱能与NaOH溶液反应
c.麻黄碱能发生加成和取代反应 d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量分数之比为42∶3∶8,
则A的含氧官能团名称是;检验该官能团的常用试剂是。
(3)反应①~⑤中属于取代反应的是(填序号)。
(4)写出D→B的化学方程式。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式。
(6)写出符合下列条件的同分异构体的结构简式。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
| 溶解性 |
沸点 |
|
| A |
微溶于水 |
179.0℃ |
| E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是。
氢化阿托醛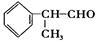 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: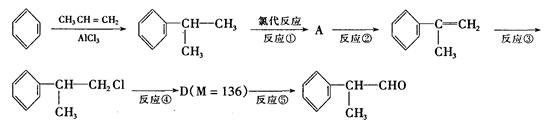
(1)在合成路线上②③的反应类型分别为②③ 。
(2)由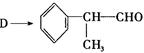 反应的化学方程式为。
反应的化学方程式为。
(3)1mol氢化阿托醛发生银镜反应最多可生成molAg。
(4)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有种。
有机物F、G是常见的塑料,可通过下图所示路线合成: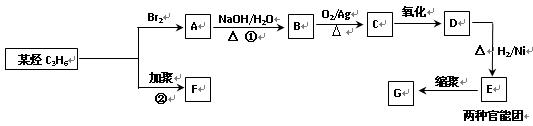
(1)高分子化合物G的结构简式是 。
(2)反应②的化学方程式是 。
(3)PBT(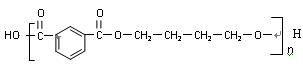 )是一种重要的工程塑料。
)是一种重要的工程塑料。
结合所学知识,请设计方案以CH2=CHCH=CH2 、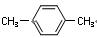 为原料合成PBT(请用反应流程图表示,并注明反应条件)。
为原料合成PBT(请用反应流程图表示,并注明反应条件)。
示例:由乙醇合成聚乙烯的反应流程图可表示为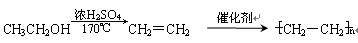
合成PBT的反应流程图为:
___________________________________________________________________________
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2 → O2
(1)写出该反应的化学方程式,并标出电子转移的方向和数目。
(2)该反应中的氧化剂是。
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为。