下列各组热化学方程式中,化学反应的△H前者大于后者的是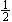 ①C(s)+O2(g)=CO2(g); △H1 C(s)+ O2(g)="CO(g); " △H2
①C(s)+O2(g)=CO2(g); △H1 C(s)+ O2(g)="CO(g); " △H2
②2H2(g)+O2(g)=2H2O(g); △H3 2H2(g)+O2(g)=2H2O(1); △H4
③CaCO3(s)=CaO(s)+CO2(g); △H5 CaO(s)+H2O(1)=Ca(OH)2(s); △H6
| A.①② | B.①③ | C.②③ | D.只有② |
已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
| A.NO2 | B.NO | C.N2O | D.NH4NO3 |
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是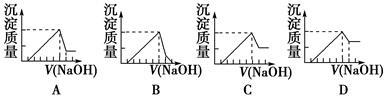
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O===2Fe2++SO +4H+ +4H+ |
| B.I2+SO2+2H2O===H2SO4+2HI |
| C.2Fe2++I2===2Fe3++2I- |
| D.H2O2+SO2===H2SO4 |
下列陈述Ⅰ、Ⅱ均正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
Fe2O3是红棕色粉末 |
Fe2O3常用作红色涂料 |
| B |
SiO2是两性氧化物 |
SiO2可和HF反应 |
| C |
Al2O3难溶于水 |
Al2O3可用作耐火材料 |
| D |
SO2有氧化性 |
SO2可使溴水褪色 |
下列关于离子反应的说法中正确的是
A.硫酸亚铁加过氧化氢溶液离子方程式为:Fe2+ + H2O2 + 2H+ Fe3+ + 2H2O Fe3+ + 2H2O |
| B.碘水中通入足量的SO2离子方程式为:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.在碳酸氢钠溶液中: K+、Al3+、SO42-、Cl-可大量共存 |
| D.使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3-可大量共存 |