已知:在25时H2O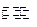 H++OH- KW=10-14
H++OH- KW=10-14
HAC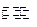 H++A
H++A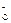 Ka=1.8×10-5
Ka=1.8×10-5
(1)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(2)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(3)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为 0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14、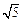 =2.2)
=2.2)
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层电子数比K层电子数多4个 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T位于元素周期表的第______周期第_____族。写出T2-的原子结构示意图______________。
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式。
(3)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
a常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是(填化学式)。
(8分)某有机物完全燃烧,生成标准状况下CO2的体积为4.48 L,H2O的质量为5.4g。
(1)若有机物的质量为3g,此有机物的结构简式为
(2)若有机物的质量为4.6g,此有机物的分子式为
(3)若有机物的质量为6.2g,且此有机物lmol能和足量的金属钠反应生成lmolH2,此有机物的结构简式为(两个羟基不能连在同一个碳原子上)
(4)等物质的量的三种有机物完全燃烧时,消耗O2最多的是
(10分)如图所示: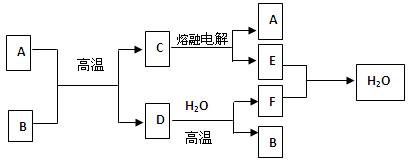
已知A、D、E、F是中学化学中常见单质,B、C是氧化物,且B的相对分子质量是232。请填空:
(1)A是,E是(填化学式)
(2)A与B反应的化学方程式是;
(3)C电解的化学方程式是;每生成lmoLA同时生成_____molE
(4)先将B溶于足量盐酸,再向用盐酸溶解后的溶液中通入足量Cl2,请写出此过程中有关反应的离子方程式
(10分)
(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA和1mol NaHCO3能完全反应,则A的结构简式是,写出与A具有相同官能团的A的所有同分异构体的结构简式
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是
(3)A与B在浓H2SO4作用下发生酯化反应后生成有机物D的结构简式
(6分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸(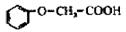 )发生化
)发生化
|
反应的产物。据此回答下列问题:
(1)甲一定含有的官能团的名称是 。