某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是 。
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择: 。
⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是 。用离子方程式解释产生气泡的原因: 。
⑶放出的气体是 ,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。(写出一点即可)
⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是 。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
| A |
正极 |
NaOH |
Al-3e-=Al3+ |
2H2O+2e-=2OH-+H2↑ |
| B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
| C |
正极 |
浓硝酸 |
Cu-2e--=Cu2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
| D |
负极 |
稀硝酸 |
Cu-2e-=Cu2+ |
2NO3-+8H+=2NO↑+4H2O+6e- |
其中正确的是 ,由此推知,金属作电极不仅与本身性质相关,而且与 ________ 有关。
已知:①通常Br2与“C=C”双键起加成反应,但高温下Br2易取代与“C=C”双键直接相连的α-碳原子上的氢原子:
②与苯环直接相连的支链碳原子上的氢原子也易被溴取代: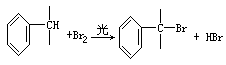
③卤代烃在一定条件下可以水解成醇:
卤代烃也可在一定条件下发生消去反应生成烯烃:
</PGN0069B.TXT/PGN>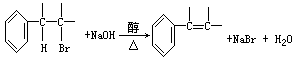
根据上述有关知识推断如何从正丙苯制取1-苯基丙三醇:C6H5—CHOH—CHOH—CH2OH,写出各步反应方程式(注明反应条件)。
磷化氢(PH3)是无色剧毒气体(沸点-89.7℃,其中含微量P2H4而易自燃。其制取原理类似于实验室制氨气,现用下图装置制取PH3并验证其性质。请回答:
(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式______。
(2)实验开始时,先从分液漏斗中往盛有碘化磷的烧瓶A中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2(SO4)3反应),微热数分钟后再从分液漏斗中向烧瓶里加入一定量的浓NaOH溶液继续加热。在B处用电热器控制温度在300℃左右,实验过程中可观察到:
①用水冷却的C中有白色蜡状固体生成。
②D试管中Fe2(SO4)3溶液的颜色由棕黄色变成淡绿色,同时也有白色蜡状物生成。
③E处点燃尾气,呈淡蓝色火焰。则:
C中的白色蜡状固体是(填分子式)______,能说明PH3具有______性质。试管D中反应的化学方程式是______,说明PH3具有______性。
(3)实验时E处尾气须点燃,原因是______。
(4)实验开始时,先向烧瓶中加入乙醚并微热,其目的是______。
(5)D中液面上有少量乙醚层,出现的原因是______
【化学——化学与技术】
1942年我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是(选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是(选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通人含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中央持、固定用的仪器未画出)。
实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入气体,再从b管中通入气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述):。

(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、。
②检查好装置的气密性后加热B前必须进行的操作是。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
装置B中可能观察到的现象是。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母):装置B中可能观察到的现象是。
实验室可用NaNO3和浓H2SO4反应制取少量的硝酸(1)写出该反应的化学方程式______。
(2)必须用固体NaNO3的原因是______。
(3)实验时加热温度不宜过高的原因是______。
(4)实验装置中,不能用橡胶塞、橡胶导管的原因是______。