( 14分)在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g) + Y(g) a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为 。
(2)写出该反应平衡常数K的表达式  (a必须用具体的值表示)。
(a必须用具体的值表示)。
(3)下列说法中能说明该反应达到了化学平衡状态的是 。
A.容器内压强一定 B.容器内气体的密度一定
C.容器内Z分子数一定 D.容器内气体的质量一定
(4)X的转化率α= ,Y的平衡浓度为 。(均用含Q、Q1的代数式表示)
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
A是烃的衍生物,加热时在NaOH溶液中水解,并能发生下列转变关系:
若A、B、C、E均能发生银镜反应,试写出它们的名称:
A:___________;B:__________;C:___________;D:___________;E:___________。
【化学——选修5:有机化学基础】
已知某有机物A为烃类化合物,其相对分子质量为70,各物质之间的转化关系如下图所示,其中B、D、E的结构中均含有2个甲基,且核磁共振氢谱都有4个峰。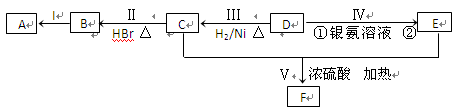
(1)A的分子式为,D中所含官能团的名称为。
(2)I的反应条件为,Ⅲ的反应类型为。
(3)写出反应Ⅳ中①的化学方程式。
(4)写出反应Ⅴ的化学方程式。
(5)E有多种同分异构体。其中:
①能发生银镜反应,又能与金属钠反应生成氢气,但不能发生消去反应:;
②能在酸性条件下水解,且两种水解产物相对分子质量相同:。
【化学——选修3:物质结构与性质】
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下: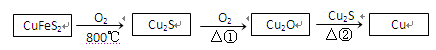
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是、。
(2)基态铜原子的核外电子排布式为,硫、氧元素相比,第一电离能较大的是。
(3)反应①和②生成的气体分子的中心原子的杂化类型是,分子的空间构型是。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因;在该晶体中存在化学键的种类有。
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为g·cm-3(用NA表示阿伏加德罗常数的数值)。
【化学——选修2:化学与技术】
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:
(1)沸腾炉中发生反应的化学方程式为;接触室中发生反应的化学方程式是。
(2)沸腾炉出来的炉气需要精制,如果不经过精制,对SO2催化氧化的影响是
(3)硫酸工业是一种易造成多种形式污染的工业,工业上常采用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理:;对矿渣的合理利用方法是。
(4)某工厂用500t 含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是t。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和无色、有臭鸡蛋气味的气体E,D既能溶于强酸,也能溶于强碱。E分子含18个电子,在足量空气中燃烧生成G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)组成单质A的元素位于周期表中第周期第族;
(2)化合物H的电子式为;
(3)B与氢氧化钠溶液反应的离子方程式为:;
(4)G与氯酸钠溶液反应可生成消毒杀菌剂二氧化氯。写出对应的离子方程式:
(5)溶液F在空气中长期放置生成H的化学反应方程式为:;
(6)写出F溶液中各离子浓度由大到小的关系为:;