向氢氧化钠溶液中慢慢地通入二氧化碳气体,反应生成正盐,当继续通入过量二氧化碳时,正盐便转化成酸式盐。
(1)写出上述反应的化学方程式
① 。
② 。
(2)标准状态下,向100 mL 2 mol·L-1 的NaOH溶液中通入3.36L二氧化碳气体,试求反应后所得溶质的物质的量为________________。
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是。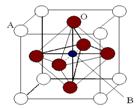
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形 成氢键
成氢键
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式:。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:。(用含x的代数式表示)
、⑶Mn的外围电子轨道表示式为:。
⑷下列有关说法正确的是。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如右图:
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对 标准。表1有(A)至(I)共九种气体在大
标准。表1有(A)至(I)共九种气体在大 气中的体积百分比及其温室效应指
气中的体积百分比及其温室效应指 数。
数。
结合表中列出的九种气体,试参与回答下列各题: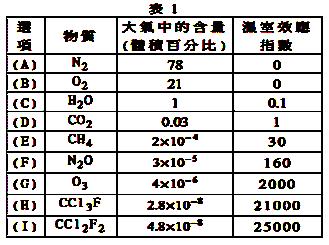
(1)下列由极性键形成的极性分子是。
A.N2 B.O2 C.H2O D .CO2E.CH4
.CO2E.CH4
(2)下列说法不正确的是。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B. C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高 压下形成的晶体
压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ Co(NH3)5(H2O)]Cl3
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ CoCl(NH3)5]Cl2·H2O。
(6)题(5)中钴离子在基态时核外电子排布式为:。
右图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种。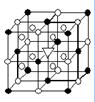
(1)图中●、○分别指代哪种粒子、 ;大立方体的体心处▽所代表的是。冰晶石在化工生产中的用途。
(2)H2S和H2O2的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| H2S |
187 |
202 |
2.6 |
| H2O2 |
272 |
423 |
以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因?
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
写出铜原子价电子层的电子排布式,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是。
(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是。
第三主族的元素由于最外能 层的p能级中有空轨道,故称为缺电子元素,在它们的化合物中常常含有配位键。
层的p能级中有空轨道,故称为缺电子元素,在它们的化合物中常常含有配位键。
⑴已知气态氯化铝的化学式为Al2Cl6,写出Al2Cl6的结构式____________________;请你设计一个简单实验证实氯化铝是型共价化合物,实验方案为:。
⑵硼酸的结构式可表示为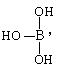 但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:。
但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:。
新型离子化合物[HC60]+[CB11H60Cl60]- 是一种功能材料。它可以用超酸 H(CB11H60Cl60)和C60反应,使C60得到质子来制取。该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式)。
H(CB11H60Cl60)和C60反应,使C60得到质子来制取。该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式)。