某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式: ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为_________.
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式: _______ _________.
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为 (请写出计算过程)
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl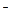 、OH
、OH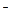 和SO
和SO
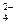 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO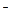 ;假设3:SO32-、ClO
;假设3:SO32-、ClO 都存在。
都存在。
设计实验方案,进行实验。请在答题卡上写出与实验步骤相应的预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI
L-1KMnO4、淀粉-KI 溶液、紫色石蕊试液.
溶液、紫色石蕊试液.
| 实验步骤 |
预期现象和结论 |
 步骤1:取少量吸收液于试管中,滴加3 moL 步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
|
| 步骤2:在A试管中滴加紫色石蕊试液 |
|
步骤3:在B试管中滴加0.01mol L-1KMnO4 L-1KMnO4 |
|
某过碳酸钠中含有少量过氧化钠,甲.乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。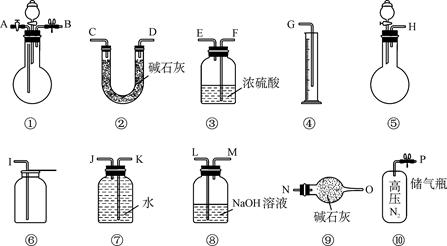
已知:过碳酸钠(Na2CO4).过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4===2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。实验中甲同学测得气体体积为V L (20 ℃,1大气压),计算时他未将V L换算到标准状况,则他得到的Na2CO4的质量分数________(填“偏高”或“偏低”')。
(2)乙同学想通过实验测得的数据是________________。按他测得的数据计算出的实验结果有可能偏高,原因是________________;也有可能偏低,原因是 。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
(1)如图所示装置,为实现下列实验目的,其中y端适合于作入口的是_____多项)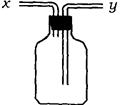
A 瓶内盛液体干燥剂,用以干燥气体
B 瓶内盛液体洗涤剂,用以除去某气体中的杂质
C 瓶内盛水,用以测量某难溶于水的气体的体积
D 瓶内贮存气体,加水时气体可被排出
E 收集密度比空气大的气体
F 收集密度比空气小的气体
(2) 浓H2SO4和木炭在加热时发生反应的化学方程式是_______________________。
图中虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,
填写下列空白。
①A中无水硫酸铜的作用_____________。
②证明SO2一定存在的现象是_____________。
③C中酸性KMnO4溶液的作用_____________。
④证明CO2一定存在的现象是_____________。
为了验证Cu和浓H2SO4反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置 . B中有无水硫酸铜、C中有品红、D中有氢氧化钠溶液
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):a接,
接,接;
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O?B中,C中;
(3)D中氢氧化钠溶液的作用是
(4)写出A中反应的化学方程式.
.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。
(1)请写出铜与稀硝酸反应的化学方程式:
。
(2)若证明无色气体是NO的实验操作和现象是。
一氧化氮是大气污染物之一。目前,有一种治理方法是在400 ℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水。该反应的化学方程式为
每有10mol N2生成,被还原的氧化剂为_______mol。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体为,将此气体通入水中,发生反应的化学方程式为:。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 |
A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
C.反应不十分剧烈,产生的气体可以在空气中燃烧 |
| ④镁带与2mol·L-1的盐酸反应 |
D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2mol·L-1的盐酸反应 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠溶液 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:________________________。
(2)实验仪器: _________________________;
(3)实验内容:请将实验方案与实验现象一一对应(*填写题给信息表中的序号),写出化学方程式
| 实验方案* |
实验现象* |
有关化学方程式 |
| |
|
|
| |
|
|
(4)实验结论:_______________________________。
(5)请用结构理论简单说明具有上述结论的原因。
(6)请你补充一组事实,说明此周期中另外两种元素的性质递变规律。