(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H="-905" kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H= 。
2NH3(g)的△H= 。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ;
②达到平衡时NH3的体积分数为 。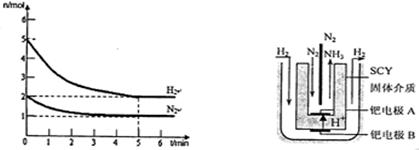
图1 图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
写出化学方程式,一步实现下列转变。
①Al→NaAlO2
②Al2O3→AlCl3
③Fe(OH)2→Fe(OH)3
④Na2O2→Na2CO3
⑤Na2CO3→NaHCO3
FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
| 编号 |
实践操作 |
实验主要现象 |
离子方程式 |
| ① |
加入过量 铁粉 |
||
| ② |
加入少量Na2O2粉末 |
||
| ③ |
加入少量AgNO3溶液 |
(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,用化学方程式表示该反应的原理.
(2)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式
(3)取少量Fe2O3粉末(红棕色)加入适量盐酸,该反应的离子方程式为;用此溶液进行以下反应,取少量溶液于一支试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为。
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值_____,二氧化硫转化率____,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(2) 600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间有。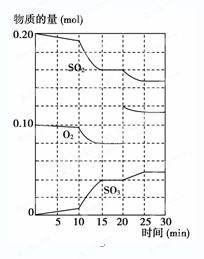
(3) 据上图判断,反应进行至20 min时,曲线发生变化的原因是___________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。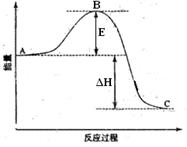
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中C表示;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是;
(2)图中△H=kJ·mol-1;
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=mol·L-1·min-1;
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=。