X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1mol X水解得到1 molY和1mol CH3CH2OH,X、Y的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且x分子中碳和氢元素总的质量百分含 量约为81.8%。
量约为81.8%。
(1)1个Y分子中应该有 个氧原子。
(2)X的分子式是 。
(3)G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:
①写出A的结构简式 。
②E→F的反应类型是 反应,该反应的化学方程式为 。
③写出所有符合下列条件的F的同分异构体的结构简式: 。
i.分子内除了苯环无其他环境结构,且苯环上有2个对位取代基。
ii.一定条件下,该物质既能与银氨溶液发生银镜反应也能和FeCl3溶液发生显色反应。
下面有6种有机物,用提供的试剂分别鉴别,将所用试剂及产生的现象的序号填在各个横线上。
(1)________;(2)________;(3)________;(4)________;
(5)________;(6)________。
| 有机物 |
试剂 |
现象 |
| (1)甲苯 (2)苯乙烯 (3)苯酚 (4)葡萄糖 (5)淀粉 (6)蛋白质 |
a.溴水 b.酸性高锰酸钾溶液 c.浓硝酸 d.碘水 e.三氯化铁溶液 f.新制氢氧化铜 |
A.橙色褪去 B.紫色褪去 C.呈蓝色 D.出现红色 沉淀 E.呈黄色 F.呈紫色 |
在下列物质中:①K2SO4、②HCHO、③MgSO4、④Hg(NO3)2、⑤NH4Cl、⑥KOH,能使蛋白质变性的是________,能使蛋白质发生盐析的是________。
现有通式为(CH2O)n的六种有机物,性质如下:
①甲是无色有刺激性气味的气体,可以发生银镜反应;
②乙、丙、丁的相对分子质量均为甲的2倍,戊的相对分子质量是甲的3倍,己的相对分子质量是甲的6倍;
③乙、戊的水溶液可使紫色石蕊试液变红,还可以与乙醇在一定条件下酯化,乙和戊之间也能酯化;
④戊结构中含有—CH3,两分子戊可形成环状酯;
⑤丙不溶于水;丁、己两种物质的水溶液均呈中性;丙既能水解,又能发生银镜反应;丁能与钠反应放出H2,且能与新制Cu(OH)2悬浊液加热反应产生红色沉淀;己能发生银镜反应,它可由淀粉水解制得。
(1)推断各物质的结构,写出其结构简式。
甲________,乙________,丙________,
丁________,戊________,己________。
(2)甲~己中能与NaOH溶液反应的是________,(填序号,下同)能发生酯化反应的是________,能被H2还原为醇的是________,能发生银镜反应的是________。
某厂以甘蔗为原料制糖,对产生的大量甘蔗渣按下图所示转化进行综合利用。其中B是A水解的最终产物;C的化学式为C3H6O3,一定条件下2个C分子间脱去2个水分子可生成一种六元环状化合物;D可使溴水褪色;F是具有香味的液体。(图中部分反应条件及产物没有列出)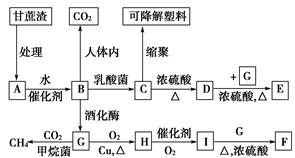
回答下列问题:
(1)A的名称是________,F的结构简式__________,
D的结构简式________。
(2)C→D的反应类型为________。D→E的反应类型为________。
(3)写出下列反应的方程式:
A→B:______________________________;
G→H:______________________________________。
(4)H分子所含官能团的名称是________,实验室中常用于检验该官能团的试剂的名称是(只写一种)_____________________________。
分别取1 mol葡萄糖进行下列实验:
(1)银镜反应时,需银氨络合离子________mol,反应后葡萄糖变为________,其结构简式是_________________________。
(2)与乙酸反应生成酯,从理论上讲完全酯化需要________g乙酸。
(3)若使之完全转化为CO2和H2O,所需氧气的体积在标准状况下为________L,反应的方程式是__________________________。