(1)下图是目前世界上比较先进的电解饱和食盐水制碱技术——离子交换膜,分别写出①、④、⑤各表示什么物质:① ④ ⑤ 
(2).使用氯化钠作原料可以得到多种产品。
①实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
②某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是________。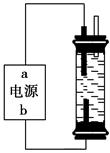
| A.a为正极,b为负极;NaClO和NaCl | B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl | D.a为阴极,b为阳极;HClO和NaCl |
③实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是_______________。
填空
(1)、甲溶液的pH是2,乙溶液的pH是4,求甲溶液和乙溶液的c(H+)之比为 。
(2)、电解饱和食盐水时,阴极析出气体是 (填化学式)。
(3)、现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是 。(结合离子反应方程式说明)
(4)、已知25℃时,醋酸和亚硫酸的电离平衡常数:醋酸K=1.75×10-5 ,亚硫酸K1=1.54×10-2、
K2=1.02×10-7。则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH H2SO3(填>、<或=)。
(5)、向明矾溶液中逐滴加入Ba(OH)2溶液,若加至铝离子刚好完全沉淀,请写出反应的离子反应方程式: 。
(6)、炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请写出铁锅腐蚀正极的电极反应式: 。
某河道两旁有甲乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl—、OH—、NO3—六种杂质离子,甲厂的废水是无色透明的,乙厂的废水有明显的颜色。
(1)甲厂的废水中所含的三种离子是 。
(2)乙厂的废水有明显的 色
(3)将甲厂和乙厂的废水按适当的比例混合,可使废水中的 (填离子符号) 化为沉淀,过滤所得的废水中主要含 ,可用来浇灌农田。
按要求用化学用语回答下列问题:
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试剂是 ,
离子方程式为 。
(2)在呼吸面具中,Na2O2 起反应的化学方程式为 。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是___ _。(用化学方程式表示).
(4)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是_____ ____(写化学式).
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有__________。
有下列物品或设备:
①陶瓷餐具 ②砖瓦
③水泥路桥 ④门窗玻璃
⑤水晶镜片 ⑥石英钟表
⑦玛瑙手镯 ⑧硅太阳能电池
⑨光导纤维 ⑩计算机芯片
(1)用到硅单质的是______ _______。
(2)所用材料为SiO2或要用到SiO2的是_____ _______。
(3)所用材料为硅酸盐的是_____ _______。
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。