某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 ,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量
分数是
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不在用盐酸,为什么
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是:
(3)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条, 观察到有产生,点燃有爆鸣声,此气体是,产生该气体的原因是(用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是,产生该气体的原因是,总的离子反应方程式为。
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c回答)。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是,pH由大到小的顺序是。
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是。
在①CH2===CH2,② ,③CH3CH2OH,④CH3COOH,⑤聚乙烯五种物质中:
,③CH3CH2OH,④CH3COOH,⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是________;
(2)属于高分子化合物的是________;
(3)能与Na2CO3溶液反应的是________;
(4)能发生酯化反应的是________;
(5)既能发生取代反应又能发生加成反应的是________。
在下列物质中是同系物的有________;互为同分异构体的有________,互为同素异形体的有________,互为同位素的有________,是同一种物质的有________。
(1)液氯(2)氯气(3)白磷(4)红磷(5)D (6)T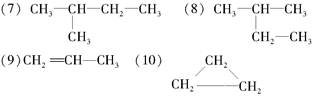
(11)2,2-二甲基丁烷
12.8 g铜片与某浓度的硝酸反应后,铜片全部溶解,生成气体的体积在标准状况下为4.48 L。试计算:
(1)被还原的硝酸的物质的量为;
(2)4.48 L气体中各成分的物质的量为。