下列有关热化学方程式及其叙述正确的是
| A.氢气的燃烧热为285.5kJ/mo1,则水电解的热化学方程式为: 2H2O(l)===2H2(g)+O2(g);ΔH=+285.5kJ/mol |
| B.1mol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,它的热化学方程式为1/2CH4(g)+O2(g)===1/2CO2(g)+H2O(l);ΔH=-445kJ/mol |
| C.已知2C(s)+O2(g)===2CO(g);ΔH=-221kJ·mol-1,则C的燃烧热为110.5kJ/mol |
| D.HF与NaOH溶液反应:H+(aq)+OH—(aq)===H2O(l);ΔH= -57.3kJ/mol |
元素X和元素Y在周期表中位于相邻的两个周期,X和Y两原子核外电子总数之和为19,Y原子核内质子数比X多3个,下列叙述正确的是
| A.X和Y都是性质活泼的元素,在自然界中只能以化合态存在 |
| B.X和Y形成的化合物的化学式为Y2X |
| C.X的最高正价为+6 |
| D.Y能置换酸中氢,放出氢气,但不能置换出盐中的金属 |
下列每组的三种物质中,两边的固体均有导线连接,插入中间的液体中,其中能组成原电池的是
| A.Zn | H2SO4(稀) | C | B.Cu | 酒精 | Ag |
| C.Zn | CCl4 | Cu | D.Fe | H2SO4(稀) |  Fe Fe |
下列电子式或结构式错误的是
A.OH-的电子式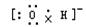 |
B.NH4Br的电子式 |
C.CCl4的电子式 |
D.H2O的结构式 H-O-H H-O-H |
下列各组元素性质递变情况错误的是
| A.Li、Be、B原子最外层电子数逐渐增多 | B.N、O、F原子半径依次增大 |
| C.P、S、Cl最高正价依次升高 | D.Li、Na、K、Rb的金属性依次增强 |
在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素种数为
| A.1种 | B.2种 | C.3种 | D.4种 |