(1)某化学实验小组从市场上买来一瓶食用白醋(含CH3COOH),用实验室标准NaOH溶液对其进行滴定以测定醋酸浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂 的变色范围:
的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
①该实验应选用 作指示剂。
②下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;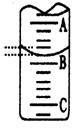
③为减小实验误差,该同学一共进行了三次实验,假设每
次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验
结果记录如下: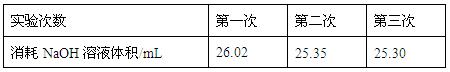
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验 结束时,俯视刻度线读取滴定终点时NaOH溶液的体积 结束时,俯视刻度线读取滴定终点时NaOH溶液的体积 |
| B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液 |
| C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗 |
| D.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定 |
(2)乙二酸俗 名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。查阅资料得知,草酸易溶于水,有还原性,可以用酸性KMnO4溶液进行滴定:
名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。查阅资料得知,草酸易溶于水,有还原性,可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。
称取1.260 g纯草酸晶体,配制成100.00 mL水溶液为待测液;
取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4;
用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
请回答:
① 滴定时,将KMnO4标准液装在下图中的 (填“甲”或“乙”)滴定管中。\
滴定时,将KMnO4标准液装在下图中的 (填“甲”或“乙”)滴定管中。\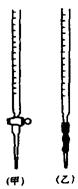
②本实验滴定达到终点的标志是
③通过上述数据,计算出x=
用苯甲醛制备苯甲醇和苯甲酸,已知反应原理: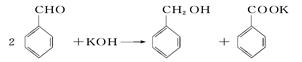
苯甲醛易被空气氧化;苯甲酸的熔点121.7℃,沸点249℃,溶解度0.34g(常温);苯甲醇的沸点为205.3℃;乙醚的沸点34.8℃,难溶于水。
制备苯甲醇和苯甲酸的主要过程如下: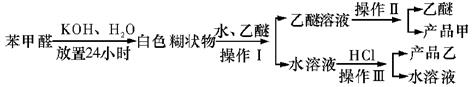
(1)混合苯甲醛、氢氧化钾和水应选用的仪器是(填序号)。
A.容量瓶 B.烧杯 C.带胶塞的锥形瓶
(2)操作II的名称是,产品甲的成分是。
(3)操作III的名称是,产品乙是。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: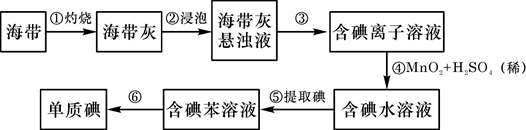
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是()
(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 |
| B.坩埚 |
| C.表面皿 |
| D.泥三角 |
E.酒精灯
F.干燥器
(2)步骤⑤的仪器名称是;
(3)步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(4)若反应后有Mn2+步骤④反应的离子方程式是。
(5)步骤⑤中,某学生选择用苯来提取碘的理由是。
用Na2CO3·10H2O晶体,配制0.2 mol/L的Na2CO3溶液480 mL。
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺________,_________;
(2)应用托盘天平称取Na2CO3·10H2O的晶体的质量为_____________g;
(3)配制溶液时有以下几个操作:
①溶解②摇匀③洗涤④冷却⑤称量⑥转移溶液⑦定容
简述操作⑦的具体过程:__________________。
(4)根据下列操作对所配溶液的浓度各有什么影响,完成填空:
①碳酸钠失去了部分结晶水
②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
其中引起所配溶液浓度偏高的有____________,无影响的有________。(填序号)
下图是实验室中制备气体或验证气体性质的装置图。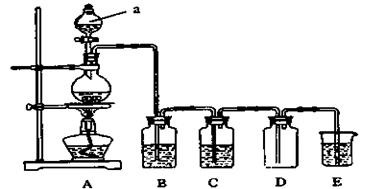
(1)仪器a的名称是_________________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为______________________________;
②装置B中溶液为________________,烧杯E中溶液的作用为____________。
(3)若利用图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。圆底烧瓶内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是_______________,现象是_______________;
②证明SO2具有还原性的现象是_____________________________________;
③D装置的作用是________________________________________。
④证明生成气体中含有CO2的现象是__________________________________;
Ⅰ、亚硫酸钠中的硫元素为+4价,请选择下面所提供的化学试剂,设计简单的实验,证明亚硫酸钠既有氧化性,又有还原性。(所提供的试剂为:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、NaOH溶液、氨水)
(1)要说明Na2SO3具有氧化性,应选用的试剂是,观察到的现象是。
(2)要说明Na2SO3具有还原性,应选用的试剂是,反应的离子方程式是_______________。
Ⅱ、某亚硫酸钠试剂已被部分氧化。为了确定它的纯度,要进行如下实验:
①称取样品 a g;
②将样品溶解;
③在溶液中加入稍过量的盐酸酸化的BaCl2溶液;
④将沉淀过滤,洗涤、干燥后称重,质量为b g。
试回答:
(1)BaCl2溶液要用盐酸酸化的原因是;
(2)BaCl2溶液要稍过量的原因是;
(3)判断沉淀是否洗尽的方法是;
(4)Na2SO3样品纯度的计算式是。
III、现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。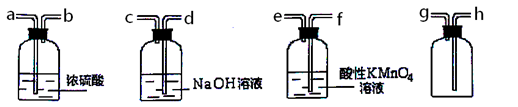
①要达到实验目的,按气流从左到右,各接口连接顺序正确的是_______。
A.dcabhB.feabhC.feabg
②本实验除去SO2的原理是利用SO2的________性质。