W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反映为黄色。下列判断正确的是
A.金属性:Y Z Z |
B.氢化物的沸点: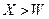 |
C.离子的还原性: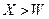 |
D.原子及离子半径: |
在0.lmol/L的HA溶液中存在如下电离平衡: HA A-+H+,对于该溶液,下列叙述正确的是( )
A-+H+,对于该溶液,下列叙述正确的是( )
| A.滴加少量0.lmol/L HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 |
| B.加水,溶液中所有离子浓度均减小 |
| C.加入少量NaA固体,平衡向逆反应方向移动, 溶液中c(OH-)增大 |
| D.加入少量NaOH固体,平衡向正反应方向移动, 溶液中c(H+)增大 |
在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应是( )
| A.0.01mol·L-1的CH3COOH与pH=12的NaOH溶液等体积混合 |
| B.0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合 |
| C.CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7 |
| D.0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是()
| A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
2SO2(g)+O2(g) 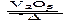 2SO3(g)是制备硫酸的重要反应。下列叙述正确的
2SO3(g)是制备硫酸的重要反应。下列叙述正确的
| A.催化剂V2O5不改变该反应的逆反应速率 |
| B.增大容器体积,反应速率一定增大 |
| C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为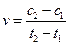 |
反应N2O4(g) 2NO2(g);ΔH="+57" kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);ΔH="+57" kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C