利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
⑴染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 ▲ 。
⑵废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)= ▲ mol/L。
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 ▲ 。与方法一相比,方法二的优点为 ▲ 。
⑶三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
CCl2=CHCl +·Cl→·CCl2CHCl2 
·CCl2CHCl2 + O2→·OOCCl2CHCl2
·OOCCl2CHCl2→·OCCl2CHCl2 + 1/2O2
·OCCl2CHCl2→CHCl2COCl +·Cl
该反应的总化学反应为 ▲ 。
有机化合物A~H的转换关系如下所示:
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是 ,名称是________________;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是 ;
(4)①的反应类型是___________;③的反应类型是________________
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B所有可能的结构简式
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为 。
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
有人设想合成具有以下结构的烃分子。
(1)结构D显然是不可能合成的,原因是。
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,写出金刚烷的分子式。
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是。
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)C的一种属于芳香烃的同分异构体是生产某塑料的单体,写出合成该塑料的化学方程式。
德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成的(如图所示)。请回答:
C20分子中共有个正五边形,共有条棱边。
C20晶体属于(填晶体类型)。
有下列转代关系: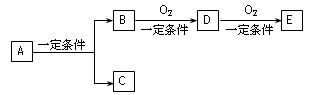
(1)若C是可用来自来水消毒的气体,D、E是氧化物,D能化为E时增加氧的质量是总质量的25.8%,则A是(写化学式)并写出A在一定条件下生成的C的化学方程式。
(2)若E是酸酐,且为无色易挥发的晶体,A为气态氢化物,则A与D反应生成B的化学方程式为。
(3)若C是水,B是无氧化合物,且在同系物中是相对分子质量最小的化合物;E能使紫色石蕊试液显红色,则A的结构简式为。A、B、D、E中易溶于水的是。(写结构简式)
(4)写出(3)中下列反应的化学方程式,注明反应类型:
D→E 反应类型为__________。