有下列转代关系: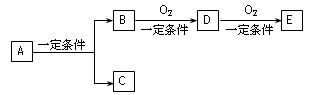
(1)若C是可用来自来水消毒的气体,D、E是氧化物,D能化为E时增加氧的质量是总质量的25.8%,则A是 (写化学式)并写出A在一定条件下生成的C的化学方程式 。
(2)若E是酸酐,且为无色易挥发的晶体,A为气态氢化物,则A与D反应生成B的化学方程式为 。
(3)若C是水,B是无氧化合物,且在同系物中是相对分子质量最小的化合物;E能使紫色石蕊试液显红色,则A的结构简式为 。A、B、D、E中易溶于水的是 。(写结构简式)
(4)写出(3)中下列反应的化学方程式,注明反应类型:
D→E 反应类型为__________。
以对甲酚(A)为起始原料,通过一系列反应合成有机物E的合成路线如下: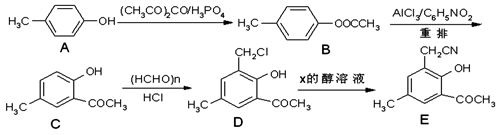
(1)A→B的反应类型为。
(2)C的核磁共振氢谱有个峰。
(3)D→E的反应中还生成了NaCl,则X的化学式为。
(4)写出同时满足下列条件的D的同分异构体的结构简式:(任写一种)。
(1)A→B的反应类型为。
(2)C的核磁共振氢谱有个峰。
(3)D→E的反应中还生成了NaCl,则X的化学式为。
(4)写出同时满足下列条件的D的同分异构体的结构简式:(任写一种)。
①苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种
②与Na2CO3溶液反应放出气体
(5)已知:R-CN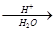 R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式:。
R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式:。
(6)写出以对甲酚和乙醇为主要原料制备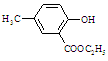 的合成路线流程图,(无机试剂任用)。流程图示例如下:
的合成路线流程图,(无机试剂任用)。流程图示例如下:
CH3CH2OH 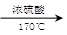 H2C=CH2
H2C=CH2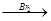 BrH2C-CH2Br
BrH2C-CH2Br
以下是某课题组设计的合成聚酯类高分子材料的路线:
已知:①A的相对分子质量小于110,其中碳的质量分数约为0.9。
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮: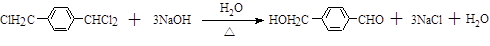
③C可发生银镜反应。
请根据以上信息回答下列问题:
(1)A的化学式为。
(2)由B生成C的化学方程式为;
该反应过程中生成的不稳定中间体的结构简式应是。
(3)D生成高分子材料的方程式为________________,D的同分异构体中含有苯环且水解产物之一为乙酸的有______种,写出其中一种结构简式。
钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。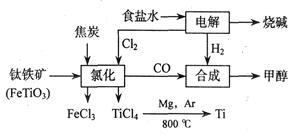
(1)电解食盐水时,总反应的离子方程式_____。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式___________________。
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应2Mg+TiCl4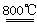 2MgCl4+Ti在Ar气氛中进行的理由是_________________。
2MgCl4+Ti在Ar气氛中进行的理由是_________________。
(4)在上述产业链中,合成96t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________________________。
现从固体KOH出发配制0.1mol/L 的KOH溶液 500mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯.玻璃棒.量筒..500ml容量瓶
(2)如果在定容时仰视操作,则所配得溶液的浓度0.1mol/L(填> , =" ," <)
(3)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度0.1mol/L (填> , =" ," <)
(4)若用250mL的H2SO4溶液恰好能将此500mL 0.1mol/L 的KOH溶液中和,则该硫酸的物质的量浓度
为mol/L,其涉及的离子方程式为
(1)写出铝和氢氧化钾溶液反应的离子方程式:
(2)实验室里制Cl2的离子方程式:
(3)检验Cl-的方法为:
(4)写出用熟石灰吸收氯气制漂白粉的化学方程式:。
(5)硅的用途为:,二氧化硅的用途为:,
(6)向FeSO4溶液中滴入NaOH溶液现象为:,请用化学方程式解释其现象:
(7)在实验室里,制取氢氧化铝的离子方程式为:
(8)过氧化钠和二氧化碳反应的化学方程式:
根据这个反应过氧化钠的用途之一为:。
(9)写出SO2使溴水褪色的化学方程式:。
(10)请写出印刷电路板时铜和FeCl3溶液反应的离子方程式:。