SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L(用含a代数式表示,计算结果保留整数)。
某同学用下图所示装置制取氯水并进行相关实验。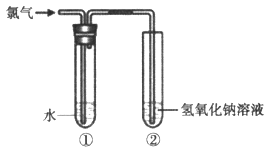
(1)装置②中反应的化学方程式是__________。
(2)实验进行一段时间后,装置①中溶液呈黄绿色,说明该溶液中含有的一种物质是(填化学式)__________。
(3)取少量装置①中的溶液滴在蓝色石蕊试纸上,试纸先变红后褪色,说明氯水具有的性质是__________。
(4)下列物质能替代NaOH溶液的是__________(填字母)。
a.浓硫酸b.FeCl2溶液c.饱和食盐水
(5)欲验证Cl2的氧化性强于I2,取少量装置①中的溶液加入盛有__________(填“KI”或“KIO3”)溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到的现象是__________。
利用物质之间的性质差异可提纯物质。
(1)除去Fe2O3中的Al2O3,反应的离子方程式是__________。
(2)除去FeCl3溶液中的CuCl2,选用的试剂是__________。
(3)除去粗盐水中Ca2+、Mg2+、 等杂质,选用的试剂是①盐酸②BaCl2③NaOH④Na2CO3
等杂质,选用的试剂是①盐酸②BaCl2③NaOH④Na2CO3
i.上述4种试剂的加入顺序是__________。
ii.加入盐酸的作用是(用离子方程式表示)__________。
钠、铝两种金属单质在生产、生活中有着广泛的应用。
(1)能与冷水发生剧烈反应的是__________,能说明该反应发生时放出热量的实验现象是__________。
(2)表面能自然形成氧化层保护内层金属不被空气氧化的是__________。
(3)__________制成的容器在常温下可用来盛装浓硝酸。
红热的铁与水蒸气可发生反应:3Fe+ ,其中铁被__________(填“氧化”或“还原”),H2O作__________(填“氧化”或“还原”)剂。在该反应中,若消耗了3 mol Fe,转移电子的物质的量是__________。
,其中铁被__________(填“氧化”或“还原”),H2O作__________(填“氧化”或“还原”)剂。在该反应中,若消耗了3 mol Fe,转移电子的物质的量是__________。
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是(填序号)。
| A.明矾 | B.二氧化氯 | C.臭氧 | D.高铁酸钠(Na2FeO4) |
(2)高铁(VI)酸盐是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物氧化法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式:。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2L(标准状况),同时生成Fe(OH)3=mol。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| 含锌废水水质 |
经处理后的水国家环保标准值 |
|
| Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
经处理后的废水pH=8,此时废水中Zn2+的浓度为mg/L(常温下,Ksp[Zn(OH)2]=1.2×1017),(填“符合”或“不符合”)国家环保标准。