现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。
⑴已知:2C(s)+O2(g)=2CO(g);ΔH1 , 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)  CO(g)+H2(g);ΔH= ▲ 。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH= ▲ 。(用含ΔH1、ΔH2的代数式表示)
⑵CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。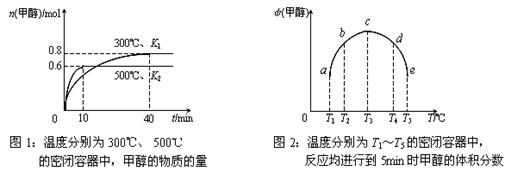
①该反应的ΔH3 ▲ 0(选填“<”、“>”或“=”,下同),K1 ▲ K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有 ▲ 。
⑶某燃料电池以CO为燃料,以空气为氧化剂,以熔融态K2CO3为电解质。写出该燃料电池负极的电极反应式: ▲ 。
奥沙拉秦是一种抗菌药。其合成路线如下:
已知: ①NaNO2具有强氧化性
②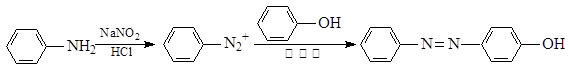
水杨酸中所含官能团的名称是。
A的分子式是。
B→C的化学方程式。
整个合成路线看,设计B→C步骤的作用是。
D的结构简式是。D→E的反应类型是。
某校化学实验室某物质M的试剂瓶标签严重破损,只能隐约看到一些信息,如相对分子质量为174等,具体如图所示。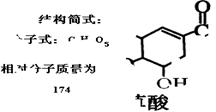
物质M分子式为_______________;M的结构简式为___________________________。
M发生加聚反应的化学方程式_______________________________________________。
M与乙醇发生酯化反应的化学方程式_________________________________________。
写出具有以下特征的M的一种同分异构体的结构简式___________________________。
①碳链、没有支链;②有酸性;③能使溴水褪色;④能在一定条件发生缩聚反应;⑤能在碱性条件下水解;⑥能发生银镜反应;
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。② Cr2O72-+ H2O 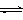 2CrO42- + 2H+
2CrO42- + 2H+ K2Cr2O7中Cr元素的化合价是。
K2Cr2O7中Cr元素的化合价是。
生成滤渣1中红褐色物质反应的化学方程式是。
滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式)。
利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是。
由滤液2转化为Na2Cr2O7溶液应采取的措施是。
向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、、过滤、洗涤、干燥。
煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是。
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在;硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I- 。
(Ⅰ)制备Na2S2O3·5H2O
打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热。圆底烧瓶中发生反应的化学方程式是。
C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。C中碳酸钠的作用
是。“停止C中的反应”的操作是。
过滤C中的混合液。将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。“过滤”用到的玻璃仪器是(填仪器名称)。
装置B中盛放的试剂是(填化学式)溶液,其作用是。
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
| 编号 |
1 |
2 |
3 |
| 溶液的体积/mL |
10.00 |
10.00 |
10.00 |
| 消耗I2标准溶液的体积/mL |
19.95 |
17.10 |
20.05 |
滴定时,达到滴定终点的现象是。
Na2S2O3·5H2O在产品中的质量分数是(用百分数表示,且保留1位小数)。
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫。
在催化剂作用下,CO2和H2可以制取甲醇和乙醇。如:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) 。
CH3CH2OH(g)+3H2O(g) 。
(Ⅰ) 在一定压强下,利用CO2反应制取乙醇,测得反应的实验数据如下表。分析表中数据回答下列问题:
 |
500 |
600 |
700 |
800 |
| 1.5 |
45 |
33 |
20 |
12 |
| 2.0 |
60 |
43 |
28 |
15 |
| 3.0 |
83 |
62 |
37 |
22 |
温度升高,平衡常数K值将(填“增大”、“减小”、或“不变”)。提高氢碳比[n(H2)/n(CO2)], 平衡常数K值将(填“增大”、“减小”、或“不变”)。
在600K时反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
(填序号)。
A.缩小反应器体积B.通入CO2C.升高温度到800K D.使用合适的催化剂
(Ⅱ)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=;
氢气的平衡浓度为mol/L。