(1)镁称为“国防金属”,常用作还原剂和脱氧剂,二氧化碳常被用作灭火剂,但是当把点燃的镁条伸入盛有CO2的集气瓶中时,镁条却能继续燃烧。请写出化学方程式 。
(2)下图变化是工业制硝酸的主要途径NH3→NO→NO2→HNO3请写出NH3→NO的化学方程式 。硝酸生产过程排放出来的NO是大气污染物之一。目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把NO还原成无色无毒气体直接排放到空气中,化学方程式为 。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。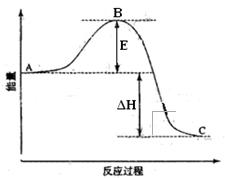
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示、,
(2)图中△H=KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求计算过程)。
有机化合物反应如下图,据此回答下列问题: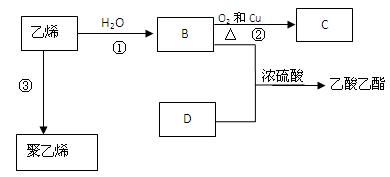
(1)乙烯的结构式为: 。
(2)写出化合物官能团的化学式及名称:
B中含官能团化学式及名称、;
D中含官能团化学式及名称、;
(3)写出反应的化学方程式
①:反应类型:
②: 反应类型:
③:反应类型:
利用盖斯定律回答下列问题:
已知热化学方程式
C(s、金刚石)+O2(g) —→ CO2(g); △H=-395.4kJ·mol—1
C(s、石墨)+O2(g) —→ CO2(g);△H = -393.5kJ·mol—1
由金刚石转化为石墨的热化学方程式为,由热化学反应方程式看来,更稳定的碳的同素异形体是。
有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷总数为36。Y元素原子最外层电子数占其核外电子总数的3/4,W元素原子最外层电子比同周期Z元素多5个电子,W和Y属于同一主族。
(1)写出元素符号:X______Y_________Z________W___________.
(2)Z、W两元素的最高价氧化物对应水化物反应的离子方程式是__________
①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:
(1)①②③④⑤五种元素中,金属性最强的元素位置是(填周期和族),该元素的单质在空气中燃烧的化学方程式为。
(2)元素①和③可以形成众多的化合物,其中最简单的是(写化学式),该化合物中,化学键的类型为(填“离子键”或“共价键”)。
(3)画出元素④的原子结构示意图,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)。
(4)写出元素⑤单质分子的电子式,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为。