已知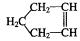 可简写为:
可简写为: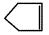 ;又已知降冰片烯的分子结构可表示为:
;又已知降冰片烯的分子结构可表示为: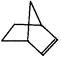
回答下列问题:
(1)降冰 片烯属于__________。
片烯属于__________。
A、环烃 B、不饱和烃 C、烷烃 D、芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
(4 )降冰片烯不具有的性质__________。
)降冰片烯不具有的性质__________。
A、能溶于水 B、能发生氧化反应
C、能发生加成反应 D、常温常压下为气体
阅读资料,获取信息,回答问题。
(A) A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C的原子序数为24;D2+的电子排布式和Ar相同。
(B)两元素电负性差值大于1. 7,原子间一般形成离子键;小于1. 7,原子间一般形成共价键。
(C)下列是周期表中部分元素的电负性x和第一电离能I1 (KJ·mol-1):
(1).A原子的轨道表示式为,B原子的价电子排布式为,C原子的电
子排布式为,D在周期表中的位置为________周期________族。
(2).电负性最小的元素位于族,第一电离能最大的元素是(填元素符号);
锂元素的电负性取值范围为<x(Li)<;A12S3属化合物
(3)标出化合物OF2、 LiAlH4中各元素的化合价(写在元素符号上)。
A、B、C、D、E代表五种元素,请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为;
(2)B元素的负一价离子的电子层结构都与氩相同,B的 离子结构示意图为;
离子结构示意图为;
(3)C原子的L电子层的P轨道上有一个空轨道,C的元素名称为。
(4)D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的电子排布式是;
(5)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为;
⑴在下列物质中:①N2、②H2O、③H2、④H2O2、⑤C2H4、⑥HCl(用序号填空)其中只含有非极性键的是;只含有极性键的是;既含有非极性键又含有极性键的是;
(2)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,计算说明N2中的键更稳定(填“σ”或“π”)。
在含有35.8gNa2CO3和NaHCO3溶液内,加入1mol/L的盐酸700ml,反应完全后可以生成8.96LCO2(标准状况)。问:
(1)其中过剩;溶液中有g Na2CO3
(2)若在上述溶液中逐滴滴加1mol/L的盐酸450 ml,反应完全后,可生成标准状况下CO2L
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
(1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为____________________。
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 _______ ____________________________。
____________________________。
(3)制取漂白粉的氯气可通过电解饱和食盐水得到。在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是。
①过滤②加过量的NaOH溶液③加适量的盐酸
④加过量的Na2CO3溶液⑤加过量的BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
(4)极滴入酚酞先变红色(填阴或阳),石墨棒的一端能使湿润的淀粉碘化钾试纸。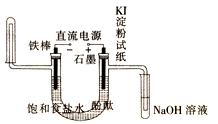
(5)假如电解饱和食盐水制取氯气,氯气制取漂白粉过程中没有任何损耗,得到715 g次氯酸钙的同时,理论上需要消耗NaCl的物质的量为多少?(4分)
g次氯酸钙的同时,理论上需要消耗NaCl的物质的量为多少?(4分)