洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
(1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为____________________。
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 _______ ____________________________ 。
____________________________ 。
(3)制取漂白粉的氯气可通过电解饱和食盐水得到。在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 。
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
(4) 极滴入酚酞先变红色(填阴或阳),石墨棒的一端能使湿润的淀粉碘化钾试纸 。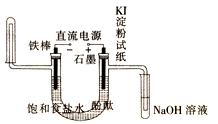
(5)假如电解饱和食盐水制取氯气,氯气制取漂白粉过程中没有任何损耗,得到715 g次氯酸钙的同时,理论上需要消耗NaCl的物质的量为多少? (4分)
g次氯酸钙的同时,理论上需要消耗NaCl的物质的量为多少? (4分)
分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题: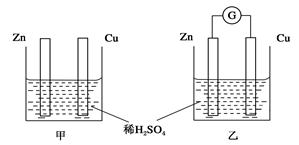
(1)以下叙述中,正确的是__________。
| A.甲中锌片是负极,乙中铜片是正极 |
| B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 |
| D.产生气泡的速度甲中比乙中慢 |
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是__________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式_________________
已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出元素符号:
A:, B:,C:_______,D:____。
(2)画出E的阴离子的结构示意图:。
(3)C的单质和D的单质在一定条件下反应生成化合物X,该反应的化学方程式为。
(4)A分别与其他四种元素形成的化合物,水溶液显碱性的是(写化学式)。
(5)将12 g B单质在足量的D单质中燃烧,所得气体通入1 L 1 mol·L-1NaOH溶液中发生反应,写出反应的离子方程式:。
Ⅰ.根据下列6种符号回答问题:
①1H ② 2 H ③ 3 H ④ 14C ⑤ 14N ⑥16O
(1)共有种核素,属于种元素。
(2)互为同位素的是。(填序号,下同)
(3)质量数相等的是,中子数相等的是。
Ⅱ.现有6种物质: ①MgCl2 ②HCl ③SO2④ K2CO3 ⑤ CaO ⑥ NaOH
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是。
(2)只含离子键的化合物是。
(3)含共价键的离子化合物是。
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素有两种常见的同素异形体,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)A元素名称是C元素在周期表中的位置。
(2)A元素的单质与水反应的离子方程式是。
(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式。该反应能否说明C元素的非金属性比B强? __(填“能”“否”)
(4)BD2和C2的水溶液均具有漂白性,二者的漂白原理————。(填“相同”或“不同”)
(5)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s) + O2(g)=BO2(g)△H =-296.8kJ·mol-1
2BO2(s) + O2(g)  2BO3(g)△H =-196.6kJ·mol-1
2BO3(g)△H =-196.6kJ·mol-1
则1 mol BO3(g)若完全分解成B(s),反应过程中的反应热DH=。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,负极材料是,以下说法中正确的是(填字母代号)
| A.①③ | B.②④ | C.①④ | D.②③ |
①以上反应是可逆反应②充电时镍元素被氧化
③电子由正极经电解质溶液流向负极④放电时电能转变为化学能
(2)写出放电时正极电极反应: