为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置: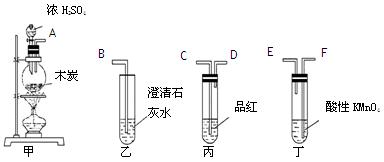
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题: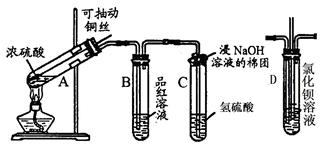
(1)A中发生的反应方程式:。
(2)试管C口部的棉团上发生反应的离子方程式是。
(3)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入Cl2气体,现象
(5)如果反应过程中要立即停止反应,最简单的方法是。
类比思想是化学学习常用的方法。已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应。该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。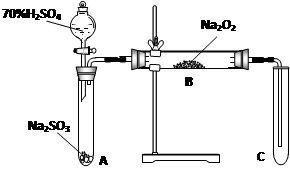
 试回答下列问题:
试回答下列问题:
(1)请写出Na2O2与CO2反应的化学方程式:_________________________________。 (2)
(2) 乙同学认为此装置存在缺陷,请你帮其完成装置的改进并简述理由:
乙同学认为此装置存在缺陷,请你帮其完成装置的改进并简述理由: ①在A、B之间加一个干燥管,
①在A、B之间加一个干燥管, 理由_________________________________。
理由_________________________________。 ②在B、C之间加一个装有溶液的洗气瓶,
②在B、C之间加一个装有溶液的洗气瓶, 理由_______________________。
理由_______________________。
(3) 任何的推论都要经过检验,请完成对白色固体成分的探究:
任何的推论都要经过检验,请完成对白色固体成分的探究: 限选实验试剂:稀盐酸、硝酸、NaOH稀溶液、蒸馏水、BaCl2溶液、澄清石灰水、品红溶液。
限选实验试剂:稀盐酸、硝酸、NaOH稀溶液、蒸馏水、BaCl2溶液、澄清石灰水、品红溶液。 ①提出合理假设:
①提出合理假设: 假设1:白色固体为Na2SO3;
假设1:白色固体为Na2SO3;
假设2:白色固体为Na2SO3与Na2SO4的混合物; 假设3: 。
假设3: 。 ②设计实验方案证明以上三种假设,完成下列填空。
②设计实验方案证明以上三种假设,完成下列填空。
步骤1:SO32-检验:取少量白色固体于试管,加入足量的,塞上单孔胶塞,将生成的气体通入品红溶液。
步骤2:SO42-检验:在步骤1反应后的溶液中加入足量的。
步骤3:结论: 若步骤1现象明显,而步骤2没明显现象,则假设1成立;若步骤1现象不明显,步骤2现象明显,则假设3成立;若上述两个实验现象均有,则假设2成立。
若步骤1现象明显,而步骤2没明显现象,则假设1成立;若步骤1现象不明显,步骤2现象明显,则假设3成立;若上述两个实验现象均有,则假设2成立。
( 10分)“84消毒液”与硫酸溶液反应可以制取氯气(NaClO+ NaCl+H2SO4 Na2SO4 + Cl2↑+H2O)为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
Na2SO4 + Cl2↑+H2O)为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置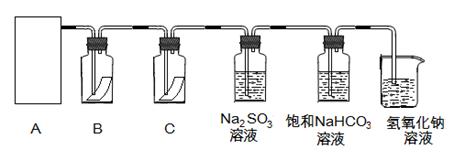
(1)从①、②、③装置中选择合适的制气装置(A处)___________ (填写序号)。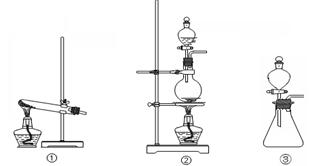
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是__________说明该装置存在明显的缺陷,请提出合理的改进的方法_______________________________
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式 ______________________________________
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 __________________________
二次合金中含有金、银、铂、钯等贵重金属,实验室以二次合金为原料提取金、银、铂、钯等贵重金属的步骤如下,试回答下列问题:
(1)浓硫酸浸煮过程中产生尾气的主要成分是(填写代号,下同),欲对该气体进行检验,最好的试剂是;
| A.H2 | B.SO2 | C.灼热的氧化铜粉末 | D.品红试剂 |
(2)操作Ⅰ的实验名称是,完成该实验需要的玻璃仪器有(填写仪器名称);
(3)实验室制备的Cl2中混有水蒸气和HCl杂质,甲同学设计了如下图所示的实验装置来证明水蒸气和HCl杂质的存在,请根据甲同学的设计意图完成下列有关问题。
①各实验装置的接口顺序为:b接,接,接a;
②装置C的作用是;
③乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置E。你认为装置E应加在
之间(填装置序号),并且在广口瓶中放入
(填写所用试剂或用品名称)。
(共13分)某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式。
(3)将沉淀物加热灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热灼烧并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是。若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是(含a、W1、W2的表达式)。
Ⅱ.有同学提出,还可以采用以下方法来测定: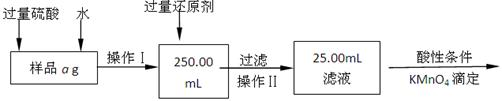
(4)选择的还原剂是否能用铁(填“是”或“否”),原因是。
(5)若一次滴定用去c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是(含a、b、c的表达式)。