二次合金中含有金、银、铂、钯等贵重金属,实验室以二次合金为原料提取金、银、铂、钯等贵重金属的步骤如下,试回答下列问题:
(1)浓硫酸浸煮过程中产生尾气的主要成分是 (填写代号,下同),欲对该气体进行检验,最好的试剂是 ;
| A.H2 | B.SO2 | C.灼热的氧化铜粉末 | D.品红试剂 |
(2)操作Ⅰ的实验名称是 ,完成该实验需要的玻璃仪器有 (填写仪器名称);
(3)实验室制备的Cl2中混有水蒸气和HCl杂质,甲同学设计了如下图所示的实验装置来证明水蒸气和HCl杂质的存在,请根据甲同学的设计意图完成下列有关问题。
①各实验装置的接口顺序为:b接 , 接 , 接a;
②装置C的作用是 ;
③乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置E。你认为装置E应加在
之间(填装置序号),并且在广口瓶中放入
(填写所用试剂或用品名称)。
下图中,(1)图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积是_________________mL。
(2)图Ⅱ表示50 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)_____________________。
| A.是a mL | B.是(50-a)mL |
| C.一定大于a mL | D.一定大于(50-a)mL |
实验室配制500 mL 0.2 mol·L-1的FeSO4溶液,操作步骤有:①在天平上称取27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水把它完全溶解。②把制得的溶液小心地注入500 mL容量瓶中。③继续向容量瓶中加入蒸馏水,至液面距刻度1 cm—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号):____________________________________________。
(2)本实验用到的基本仪器有:__________________________________________________。
(3)若俯视刻度,对所配制溶液浓度的影响是______________(填“偏低”“偏高”或“无影响”)。
(4)若没有进行④的操作,其影响是________________________________________________。
(5)若实验中出现了下列情况应如何处理:加蒸馏水时不慎超过了刻度,应________________,向容量瓶中转移溶液时(实验步骤②)不慎有液滴溅在容量瓶外面,应____________________。
某研究性学习小组欲开展一次以化学为主题的活动,确定的课题是“研究浓硫酸与木炭粉在加热条件下反应的产物”。
(1)假如你是小组成员,根据你的推测,浓硫酸与木炭粉在加热条件下反应的产物的可能是。
(2)为了验证你的推测,小组讨论确定用以下装置进行实验: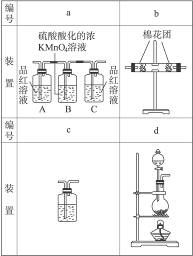
①你认为装置b中所加的固体是_____________;装置C中所加的溶液是_____________。
②甲、乙、丙三位同学分别设计了三套不同的装置如下:
甲的装置顺序:d a b c
乙的装置顺序:d b a c
丙的装置顺序:d c a b
你认为谁设计的顺序合理?为什么?推测合理的顺序中的a、b、c装置中可能出现的实验现象。
设计一个只用BaCl2溶液及试管鉴别Na2SO3溶液和稀硫酸的实验,简要写出鉴别过程。
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。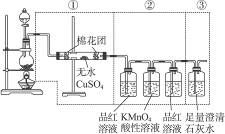
(1)如图将装置中①②③三部分仪器的连接顺序变为②①③,则可以检验出的物质是__________;不能检验出的物质是__________。
(2)如果将仪器的连接顺序变为①③②,则可以检验出的物质是__________;不能检验出的物质是__________。
(3)如果将仪器的连接顺序变为②③①,则可以检验出的物质是__________;不能检验出的物质是__________。