(共13分)某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热灼烧并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (含a、W1、W2的表达式)。
Ⅱ.有同学提出,还可以采用以下方法来测定: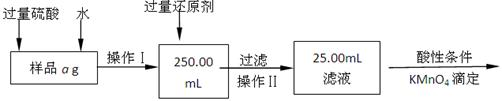
(4)选择的还原剂是否能用铁 (填“是”或“否”),原因是 。
(5)若一次滴定用去c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是 (含a、b、c的表达式)。
某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中有机反应的化学方程式________________________________
(2)已知上述反应是放热反应。观察到A中的现象是_______________________________
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___________________,写出有关的化学方程式________________________________。
(4)C中盛放CCl4的作用是___________________________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________________,现象是___________________________________________。
在实验室制各氯气的实验中:制法
(1)反应原理(方程式)为
(2)实验装置如图所示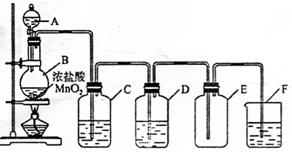
指出下列装置中所盛试剂及其作用:
C.
D.
F.
下面是某化学兴趣小组的同学做同周期元素性质递变规律实验时,设计了一套实验方案。其中实验步骤如下:
| 实验序号 |
实验步骤 |
| ① |
将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加酚酞溶液 |
| ② |
向新制得到的Na2S溶液中滴加新制的氯水 |
| ③ |
将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ |
将镁条投入稀盐酸中 |
| ⑤ |
将铝条投入稀盐酸中 |
⑴实验目的
⑵写出实验①和②中的实验现象和化学方程式
实验①:现象化学方程式
实验②:现象化学方程式
⑶实验结论
实验室用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液进行反应,通过测定反应过程中的放热来计算中和热。试回答下列问题:
(1)在本实验中除了用到大烧杯、小烧杯、温度计、量筒等仪器外,还须的一种玻璃仪器名为。
(2)两只烧杯间要填满碎纸条,其目的是;
(3)大烧杯上必须盖上硬纸板,否则,求得的中和热数值将(填“偏大”、“偏小”、“无影响”)。
(4)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=。
(5)实验中改用52mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液反应,与上述实验相比,所放出的热量(填“相等”“不相等”),所求中和热(填“相等”“不相等”)简述理由
(6)用相同浓度和体积的氨水代替烧碱溶液进行上述实验,测得的中和热的数值会;若改用50mL 0.50mol/L烧碱溶液进行上述实验,测得的中和热的数值会。(填“偏大”、“偏小”、“无影响”)
(1)欲量取20.00mL Na2CO3溶液,应选用的仪器是_________________。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、____________________。
(3)在测定硫酸铜晶体中结晶水含量的实验中,称量晶体和晶体受热失去结晶水都是在______中(填仪器名称)进行。