(19分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。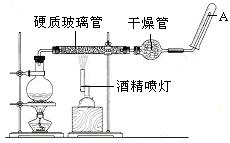
(1)写出该反应的化学方程式 ,其中氧化剂是 ,还原剂是 。8.4g铁粉参加反应,转移电子 mol。
(2)玻璃管中石棉绒的作用是 ,实验开始时应先点燃 ,实验结束时应先熄灭 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的
成分是 ,若溶液未变红色则说明硬质试管中固体物质的
成分是 。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。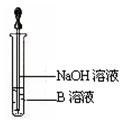
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按上图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关
的反应的化学方程式 ,
。
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是 ,
并且配制含Fe2+的盐溶液时应加入少量 。
(9分)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题: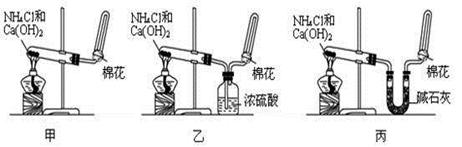
(1)三位同学制取氨气的化学方程式为: _______________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_______________________________.
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是___________填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(4 )检验氨气是否收集满的方法是(简述操作方法、现象和结
)检验氨气是否收集满的方法是(简述操作方法、现象和结 论)____________________
论)____________________
_____________________________________________________________________________。
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是___________(填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否 用NH4Cl固体代替制NH3?______________(填“能”或“不能”)。
用NH4Cl固体代替制NH3?______________(填“能”或“不能”)。
实验室用下图所示的实验装置制取纯净干燥的无水CuCl2。
|

 。8.7gMnO2与足量浓盐酸反应生成标况下的氯气 L。
。8.7gMnO2与足量浓盐酸反应生成标况下的氯气 L。
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白: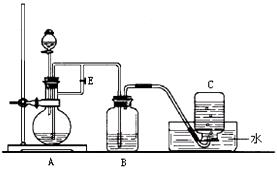
(1)B中盛有一定量的,A中应预先加入的试剂是,
A中反应的化学方程式为。
(2)实验开始时应先将活 塞E(填“打开”或“关闭”),目的是
塞E(填“打开”或“关闭”),目的是
。
(3)A反应一段时间后将活塞E(填“打开”或“关闭”),目的是 。
。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为L(标准状况)。
用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④转移、洗涤,⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是(保留到小数点后一位),量取浓硫酸所用的量筒的规格是(从下列中选:A. 10ml B. 25ml C. 50ml D. 100ml)
(2)在上述实验步骤中,需要用到玻璃棒的有(填序号)。
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至为止。塞紧瓶塞,倒转摇匀。
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A. 容量瓶用蒸馏水洗涤后残留有少量的水
B. 所用过的烧杯、玻璃棒未洗涤
(10分)1,2 — 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2- 二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式.
___________________________________________________________
___________________________________________________________
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请
写出发生堵塞时 瓶b中的现象._________________________________.
瓶b中的现象._________________________________.
(3)容器c中NaOH溶液的作用是:__________________________________.
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多.如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________________
________________________________________________________