(10分)1,2 — 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2- 二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式.
___________________________________________________________
___________________________________________________________
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请
写出发生堵塞时 瓶b中的现象._________________________________.
瓶b中的现象._________________________________.
(3)容器c中NaOH溶液的作用是:__________________________________.
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多.如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________________
________________________________________________________
请设计实验方案,用以证明某淀粉溶液,
①正在水解,②完全没有水解,③已经水解完全。
(12分)今年5月我区举行实验技能考查,某兴趣小组的同学在帮助老师准备化学实验时,发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标签破损。为了鉴定该试剂成分,同学们做了以下探究:
【提出问题】这瓶试剂的成分是什么?
[讨论]根据受损标签及实验室药品分类摆放的原则,这瓶试剂可能不是_______________________;
A.酸 B.碱 C.盐
[猜想]①可能是NaOH溶液;②可能是Na2CO3溶液;
③可能是_______________________(写一种)。
[探究活动]
(1)小军取少量试样于小试管中,滴加酚酞试液,溶液变为红色。由此小军认为猜想①正确。
经同学们交流讨论后,一致认为小军的方案不可行,理由是_______________________
(2)小华同学认为,虽然小军的实验不能得到正确的结论,但只要再往溶液中滴加一种氯化
物溶液,同样能得出正确的结论。
| 操作步骤 |
实验现象 |
实验结论 |
| 取少量滴有酚酞试液的试样于小试管中,滴加足量的___________ |
溶液由红色褪为无色 且有白色沉淀产生 |
猜想②正确 |
(3)小亮发现要进一步确定(1)中的成分,只需选择上图已有的试剂就能把它鉴定出来。于是他们进行了如下实验。
| 操作步骤 |
实验现象 |
结论及化学方程式 |
| 取少量试样于小试管中,滴加适量的_______________________ |
_________________ _________________ |
猜想②正确 有关化学方程式 _________________ |
[实验反思]实验室盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是:NaOH与玻璃中的
SiO2发生反应,其化学方程式为2NaOH + SiO2=" X" + H2O,产物X使瓶口与塞子粘合在一起。
试推测X的化学式为_________________。
(14分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下: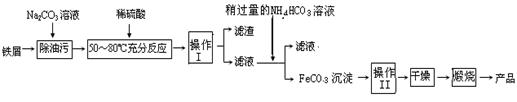
回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的名称是________。
②写出在空气中煅烧FeCO3的化学方程式;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_____________________________________________。
②某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)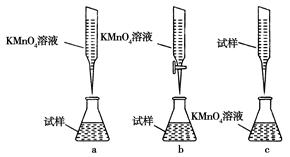
③计算上述样品中FeSO4·7H2O的质量分数为。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__________,目的是__________。
(2)反应中加入过量的乙醇,目的是__________________________。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是:____________________________________________。
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图: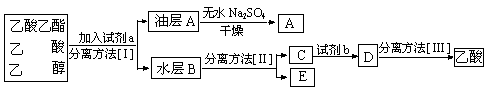
则试剂a是:____________,分离方法I是____________,分离方法II是____________,
试剂b是______________,分离方法III是______________。
(5)甲、乙两位同学欲将所得含有乙醇、乙酯和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物
乙得到了大量水溶性的物质
丙同学分析了上述实验目标产物后认为上述实验没有成功。
试解答下列问题:
①甲实验失败的原因是:_______________________________________________
②乙实验失败的原因是:_______________________________________________
制备无水乙醇的实验
原理:由于乙醇95.6%、水4.4%组成一种混合物,常压下,它有一定的沸点(78.17℃),这个沸点低于水的(100℃)也低于纯乙醇的沸点(78.3℃),所以只靠简单蒸馏酒精,所得乙醇纯度最高只能达到95.6%尚含有4.4%的水.如果要得到含量较高的乙醇,在实验室中常用的简便方法是加人生石灰回流(回流是在一个可以加热的反应容器中,把液体加热使受热转化生成的蒸气通过冷凝器冷凝又回流到原容器的操作.见图甲),回流之后再蒸馏,可得99.5%的乙醇,通常称为无水乙醇.如果要得到纯度更高的绝对乙醇(含乙醇99.95%),则还要用金属钠进行处理,借以除去最后微量的水份。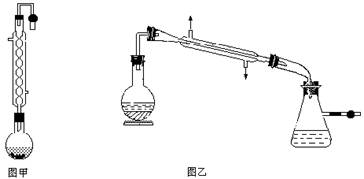
实验步骤::取干燥的250mL圆底烧瓶一只,加入95%乙醇100mL和小块生石灰30g,振摇后用橡皮塞塞紧,放置过夜。在烧瓶口装上回流冷凝管,管口接一支氯化钙干燥管(装置见图甲),在水浴上加热回流1至2小时,稍冷,取下冷凝管,改装成蒸馏装置(如图乙),再放在热水浴中蒸馏,把最初蒸出的5mL馏出液另外回收,然后用烘干的吸滤瓶作为接受器,其侧管接一支氯化钙干燥管,使其与大气相通,蒸至无液滴出来为止,量取所得乙醇的体积,计算回收率。请回答;
(1)为什么回收或蒸馏时都要装上氯化钙干燥管?____________________________
(2)为了防止回流系统外部湿气侵入,有人用塞子把冷凝管上端塞紧,这样做为什么不行?___________________________________________
(3)无水氯化钙常用作吸水剂,如用无水氯化钙代替氧化钙投入酒精中,放置过夜,然后不经过滤,进行本实验制取乙醇是否可行,为什么?__________________________
(4)一般用干燥剂干燥有机物时,在蒸馏前应先过滤,但用氯化钙制备无水乙醇时,为什么可不过滤,留在瓶中一起蒸馏?__________________________________
(5)为什么最初蒸出的5mL馏出液另外收集,它的纯度是否已达99.5%?
________________________________________________