用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④转移、洗涤,⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是 (保留到小数点后一位),量取浓硫酸所用的量筒的规格是 (从下列中选:A. 10ml B. 25ml C. 50ml D. 100ml)
(2)在上述实验步骤中,需要用到玻璃棒的有 (填序号)。
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至 为止。塞紧瓶塞,倒转摇匀。
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A. 容量瓶用蒸馏水洗涤后残留有少量的水
B. 所用过的烧杯、玻璃棒未洗涤
某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回答下列问题。
(1)装置甲中仪器A的名称是___________,甲装置中发生反应的化学方程式为_________。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
Ⅱ方案:采用酸碱中和滴定法测定。
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
继而进行下列判断和实验:
①判定I方案不可行,理由是__________________;
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00mL,用0.1000mol•L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为_______________;
b.平行滴定后获得实验结果
③判断Ⅲ方案的实验结果___________(填“偏大”、“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
(3)装置乙中浓硫酸的作用是_________________________________________________,装置丙的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
(5)将制取的氯气通入下图所示装置中,B装置溶液中具有氧化性的含氯离子是_______;如何证明C装置中FeCl2溶液与Cl2发生了反应?_________________________(只回答需要的试剂和现象)。
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤.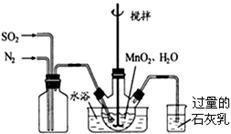
①写出左边集气瓶的作用。
②石灰乳的作用是:(用化学方程式表示)
③写出MnO2和H2SO3反应的离子反应方程式。
④反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有(选择选项填空)。
a.缓慢通入混合气体 b.快速通入混合气体
c.控制适当的温度d.高温加热
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)时制得的MnSO4制备高纯MnCO3的操作步骤【实验中可选用的试剂: Ca(OH)2、NaHCO3、Na2CO3、C2H5OH】。
①边搅拌边加入Na2CO3,并控制溶液pH<7.7;
②;
③检验SO42-是否被洗涤干净。洗涤时(填“是”或“否”)必须加盐酸酸化;
④用少量洗涤;
⑤低于100℃干燥。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如下图所示。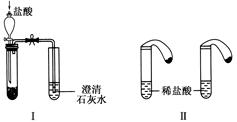
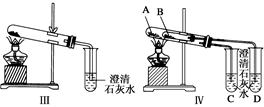
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是______(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:______________
(3)与实验Ⅲ相比,实验Ⅳ的优点是________(填选项序号)。
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(4)Ⅲ中加热碳酸氢钠时,澄清石灰水会变浑,石灰水变浑反应的离子方程式
(5)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入物固体最好是________(填化学式)
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。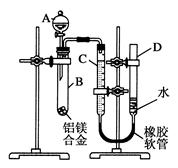
(1)A中的试剂为
(2)B中发生反应的化学方程式为
(3)若实验用铝镁合金的质量为ag,测得 氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为cg,则铝的质量分数为,铝的相对原子质量为____________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”或“不受影响”)
某研究性学习小组进行了如下实验探究:将适量1.00 mol·L-1 CuSO4溶液和2.00 mol·L-1 NaOH溶液混合,过滤后得到浅绿色碱式盐沉淀A[化学式:aCu(OH)2·CuSO4]。将9.08 g A隔绝空气在1000℃左右强热,得到了5.76 g砖红色固体B(铜的+1价氧化物),同时得到了混合气体C;再将5.76 g B溶于过量稀硫酸得到2.56 g另一种红色固体D和蓝色溶液。
(1)实验需用1.00 mol·L-1 CuSO4溶液480mL,配制以上溶液需用的玻璃仪器除了烧杯、玻璃棒、量筒外还需_________________________________;所称取的胆矾固体是________g;配制溶液浓度会导致所配溶液浓度偏高的是__________。
| A.称量质量正确,但胆矾晶体部分失结晶水 |
| B.配制溶液时,定容时仰视容量瓶刻度线 |
| C.称量胆矾时把胆矾放在右盘称 |
| D.定容摇匀后发现液面低于刻度线,再往容量瓶里加水定容至刻度 |
(2)B与稀硫酸反应的化学方程式为________________________________________。
(3)甲同学认为A中可能含有杂质Na+,验证此判断正确的方法是______________。
(4)气体C的成分:__________________________(SO3和SO2不需填)。
(5)通过计算确定A的组成为_______________________________。