实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
(1)过滤时需要用到的玻璃仪器是 。
(2)检验加入BaCl2溶液后SO42-是否沉淀完全的操作为 。
(3)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由 。
(4)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液。
他的思路如下:
沉淀A的化学式是 ,溶液③中的溶质是 。
聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
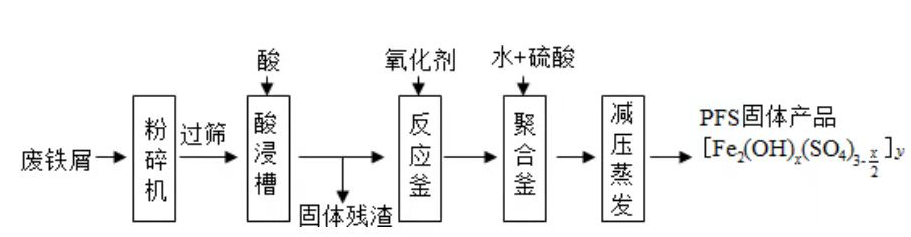
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为________.粉碎过筛的目的是________.
(2)酸浸时最合适的酸是________,写出铁锈与酸反应的离子方程式________.
(3)反应釜中加入氧化剂的作用是________,下列氧化剂中最合适的是________(填标号).
| A. |
|
B. |
|
C. |
|
D. |
|
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时 水解程度弱,pH偏大时则________.
(5)相对于常压蒸发,减压蒸发的优点是________.
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为 (n为物质的量).为测量样品的B值,取样品 ,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰).到终点时消耗NaOH溶液 .按上述步骤做空白对照试验,消耗NaOH溶液 ,已知该样品中Fe的质量分数w,则B的表达式为________.
煤燃烧排放的烟含有 和 , 形成酸雨、污染大气,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1) 的化学名称为________.
(2)在鼓泡反应器中通入含 、 的烟气,反应温度323K, 溶液浓度为 . 反应一段时间后溶液中离子浓度的分析结果如表.
|
离子 |
|
|
|
|
|
|
c/ |
|
|
|
|
|
①写出 溶液脱硝过程中主要反应的离子方程式________.增加压强,NO的转化率________(填"提高"、"不变"或"降低").
②随着吸收反应的进行,吸收剂溶液的pH逐渐________(填"增大"、"不变"或"减小").
③由实验结果可知,脱硫反应速率________脱硝反应速率(填"大于"或"小于")原因是除了 和NO在烟气中初始浓度不同,还可能是________.
(3)在不同温度下, 溶液脱硫、脱硝的反应中 和NO的平衡分压 如图所示.
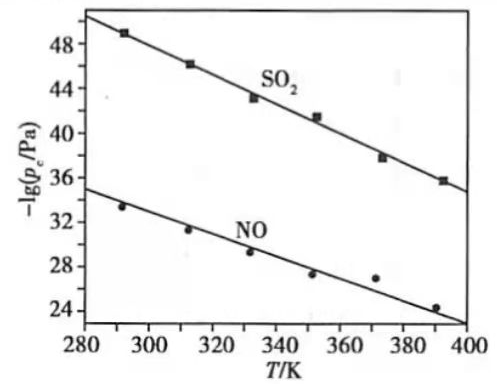
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______(填"增大"、"不变"或"减小").
②反应 的平衡常数K表达式为________.
(4)如果采用 、 替代 ,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析, 相比 具有的优点是________.
②已知下列反应:
则反应 (aq)的△H=________.
过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是________.小火煮沸的作用是使沉淀颗粒长大,有利于________.
(2)如图是某学生的过滤操作示意图,其操作不规范的是________(填标号).

| A. |
漏斗末端颈尖未紧靠烧杯壁 |
| B. |
玻璃棒用作引流 |
| C. |
将滤纸湿润,使其紧贴漏斗壁 |
| D. |
滤纸边缘高出漏斗 |
| E. |
用玻璃棒在漏斗中轻轻搅动以加过过滤速度 |
(3)(二)过氧化钙的制备
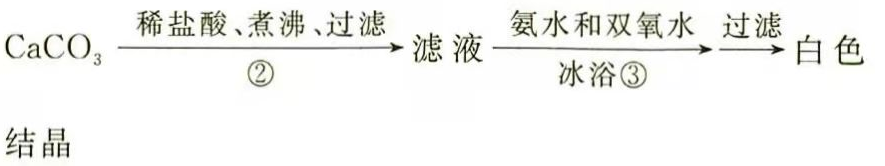
步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈________性(填"酸"、"碱"或"中").将溶液煮沸,趁热过滤,将溶液煮沸的作用是________.
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是________.
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是________.
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是________,产品的缺点是________.
水煤气变换
是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯 缓慢地通过处于 下的过量氧化钴 ,氧化钴部分被还原为金属钴 ,平衡后气体中 的物质的量分数为0.0250。
②在同一温度下用 还原 ,平衡后气体中 的物质的量分数为0.0192。
根据上述实验结果判断,还原 为 的倾向是 _________(填"大于"或"小于") 。
(2) 时,在密闭容器中将等物质的量的 和 混合,采用适当的催化剂进行反应,则平衡时体系中 的物质的量分数为_________(填标号)。
A. B. C. D. E.
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的 ________(填"大于""等于"或"小于")0。该历程中最大能垒(活化能) =_________ ,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了 时水煤气变换中 和 分压随时间变化关系(如图所示)催化剂为氧化铁,实验初始时体系中的 和 相等、 和 相等。
计算曲线a的反应在 内的平均速率 (a)=___________ 。 时 和 随时间变化关系的曲线分别是_______、_______。 时 和 随时间变化关系曲线分别是 、 。

硫酸铁铵
是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持 ,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的 ,理由是________。分批加入 ,同时为了____________,溶液要保持 小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。