实验室用下图所示的实验装置制取纯净干燥的无水CuCl2。
|

 。8.7gMnO2与足量浓盐酸反应生成标况下的氯气 L。
。8.7gMnO2与足量浓盐酸反应生成标况下的氯气 L。海带中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:(已知:Cl2 + 2KI =" 2KCl" + I2)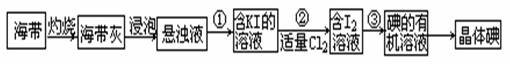
(1)提取碘的流程中:步骤①需要的主要仪器是,步骤③需要的主要仪器是(填序号)
(2)写出步骤②中涉及的有关离子反应方程式。
(3)提取碘的过程中,可供选择的有机试剂有。
| A.四氯化碳 | B.醋酸 | C.酒精 | D.苯 |
有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
① 将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
② 向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③ 取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④ 另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是,一定不含有的物质是,可能含有的物质是。(写化学式)
(2)写出各步变化的离子方程式。
① ;
② ;
③;
④
。
资料显示:“氨气可在纯氧中安静燃烧生成稳定的单质和化合物……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。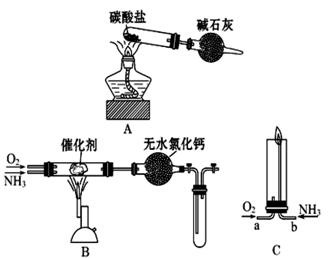
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式
是__ _ __;碱石灰的作用是____ ___。
(2)将产生的氨气与过量的氧气通到装置
B(催化剂为铂石棉)中,用酒精喷灯加热。
请写出氨催化氧化的化学方程式是 ;
试管内气体变为红棕色。
(3)将过量的氧气与A产生的氨气分别从a、b
两管进气口通入到装置C中,并在b管上端点燃氨气:①两气体通入的先后顺序是______ ___;
②氨气燃烧的化学方程式是___。
下图所示是分离混合物时常用的仪器,回答下列问题: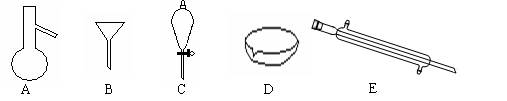
(1)写出仪器C、E的名称、
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①粗盐和泥沙:②花生油和水:
(3)下列关于仪器的使用说法正确的是
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于向酒精灯中添加酒精
C.C仪器在放出液体时应打开上边的瓶塞
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.E仪器中水的流向是上进下出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?
现某实验需要480 mL 0.2 mol/L的Na2CO3溶液,现用Na2CO3·10H2O晶体配制该溶液。
(1)① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少;
② 实验中两次用到玻璃棒,其作用分别是、。
(2) 应称取Na2CO3·10H2O晶体的质量为:。
(3)根据下列操作对所配溶液的浓度各有什么影响,将其序号填在下面空格:
①碳酸钠失去了部分结晶水;②用“左码右物”的称量方法称量晶体;
③碳酸钠晶体不纯,其中混有氯化钠;④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面;⑥摇匀后发现液面低于刻度线再加水。
其中引起所配溶液浓度:a.偏高的有;
b.偏低的有;
c.无影响的有。