2,3-二氢呋为无色易挥发液体,有温和香味,微溶于水,常温下稳定,是抗肿瘤药物的中间体,也用于电子化学品和香料中,可由丙烯为原料合成: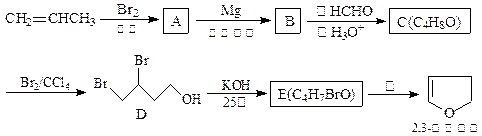
已知:
1、
2、
回答下列问题:
(1)请用系统命名法命名化合物D 。
(2)①.反应③的条件是 。
②.写出C、E的结构简式:C 、E 。
(3)工业上由化合物F(C4H10O2)在少量硫酸存在下可制得四氢呋喃,写出反应方程式: 。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式 。
① 没有支链,且一取代产物只有两种;
② 与银氨溶液不发生银镜反应。
(5)2,3-二氢呋喃在一定条件下可以转变成四氢呋喃,如何用简单的化学方法检验2,3-二氢呋喃是否完全转化?
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):
回答下列问题:
(1)混合物中是否存在FeCl2 (填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: 。
(4)请根据计算结果判断混合物中是否含有AlCl3 (填“是”或“否”),你的判断依据是 。
(10分) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是________(写化学式)。
(2)写出并配平该反应的化学方程式:__________________;
(3)发生还原反应的物质是_______,反应中2mol的氧化剂能______(填“失去”或“得到”)_____mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为___________。
海洋是巨大的化学资源宝库。下面是海水化学资源综合利用的部分流程图: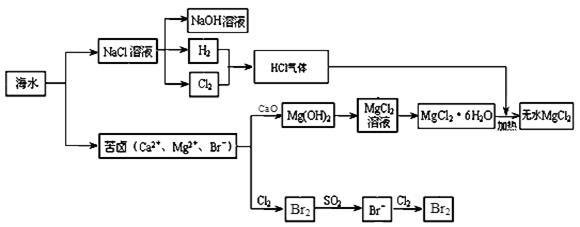
回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、____(填试剂化学式),然后____(填操作名称)。在溶液中再加适量 (填试剂),加热蒸干溶液即得到精盐。
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水。用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟。阳极生成的气体是 ,白烟的主要成分是 。
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是 。
(5)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时有CO2放出。最后再用H2SO4处理得到Br2,最后一步反应的离子方程式是__________ 。
(10分) A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去).
A 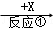 B
B 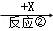 C
C
试回答:
(1)若X为O2,则A不可能是 (填选项).
a.Sib.NH3c.Mgd.S
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B溶液显碱性的原因 ,举出C的一种用途 .
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式 ,C的水溶液中各离子浓度由大到小顺序为 .
高纯度锰酸锂(LiMn2O4)是锂电池重要的正极材料。
(1)工业上有一种制取高纯度锰酸锂的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生的化学反应方程式:________。
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750 ℃共热5 h,得到锰酸锂。请写出发生的化学反应方程式:_________。
(2)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。
把分析纯碳酸锂与球形二氧化锰两种粉末,按物质的量1:4混合均匀加热。
①升温到515 ℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723 ℃)低得多。原因是________。
②升温到566 ℃时,产生另一种气体X,X恰好与CO2物质的量相等,同时得到固体B。请写出发生的化学反应方程式:_________。
③升温到720 ℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出发生的化学反应方程式:_________。